
【题目】南海是一个巨大的资源宝库,开发利用这些资源是科学研究的重要课题。下图为海水资源利用的部分过程,有关说法正确的是( )
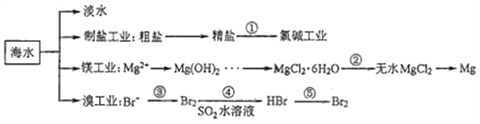
A. 海水淡化的方法主要有蒸馏法、电渗析法、冰冻法
B. 氯碱工业中采用阴离子交换膜可提高产品的纯度
C. 由MgCl2·6H2O得到无水MgCl2的关键是要低温小火烘干
D. 溴工业中③、④的目的是为了富集溴元素,溴元素在反应③、⑤中均被氧化,在反应④中被还原
【答案】D
【解析】A.海水淡化的方法主要有蒸馏法、电渗析法、离子交换法,A错误;B. 氯碱工业是电解饱和食盐水,溶液中阳极上氢离子和阴极上氯离子放电,在阴极产生氢氧化钠,为防止氯气与氢氧化钠反应采用阳离子交换膜,使钠离子转移到阴极,所以提高产品纯度,B错误;C.MgCl2溶液加热,镁离子水解生成氢氧化镁和氯化氢,氯化氢易挥发,使水解可以完全,因此由MgCl2·6H2O得到无水MgCl2的关键是抑制MgCl2的水解,C错误;D.海水提溴是先通入足量氯气氧化溴离子为溴单质,然后将溴单质还原为溴化氢,再通入适量氯气氧化溴离子为溴单质,溴得电子化合价降低,所以溴元素被还原,因此溴工业中③、④的目的是为了富集溴元素,溴元素在反应③、⑤中均被氧化,在反应④中被还原,D正确;答案选D.


科目:高中化学 来源: 题型:
【题目】德国重离子研究中心2010年2月19日宣布,由该中心人工合成的第ll2号化学元素从即日起获正式名称“Copemicium”,相应的元素符号为“Cn”。该元素的名称是为了纪念著名天文学家哥白尼而得名。该中心人工合成Cn的过程可表示为:7030Zn+20882Pb→277112Cn+10n。下列叙述中正确的是 ( )
A. 上述合成过程属于化学变化
B. Cn元素位于元素周期表的第七周期,是副族元素
C. Cn元素的相对原子质量为277
D. 277112Cn的原子核内质子数比中子数多53
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计了一个甲醇(CH3OH)燃料电池,并用该电池电解200mL一定浓度NaCl与CuSO4混合溶液,其装置如图1:
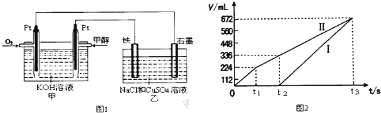
(1)25℃,1.01×105Pa时16g液态甲醇完全燃烧,当恢复至原状态时,放出362.9kJ热量,此反应的热化学方程式为 。
(2)写出甲中通入甲醇这一极的电极反应式 。
(3)铁电极上反应的现象为:先有红色的物质析出,后 。
石墨电极上产生的气体是 。
(4)理论上乙中两极所得气体的体积随时间变化的关系如图2所示(气体体积已换算成标准状况下的体积)原混合溶液中CuSO4的物质的量浓度 mol·L-1。(假设溶液体积不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1molL-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图 所示。下列判断正确的是
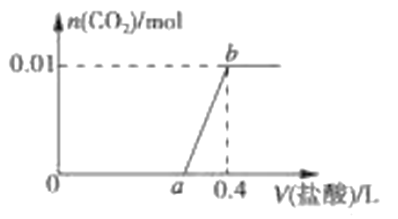
A. 在0a范围内,只发生NaOH和HCl的反应
B. ab段发生反应的离子方程式为:CO32-+2H+=CO2↑+H2O
C. a=0.3
D. 原混合溶液中NaOH与Na2CO3的物质的量之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下pH=13的强碱溶液与pH=2的强酸溶液混合,所得混合溶液的pH=11,求强碱与强酸的体积比(溶液的体积变化忽略不计)是________________。
(2)取浓度相同的NaOH和HCl溶液,以3 :2体积比相混合,所得溶液的pH等于12,则该原溶液的浓度(溶液的体积变化忽略不计)为__________________。
(3)常温下,PH=11的NH3·H2O与PH=3的盐酸等体积混合,混合溶液中,离子浓度关系为_________________________________________。
(4)已知:Ksp(FeS)=6.5×10-18,Ksp(CuS)=1.3×10-36。向浓度均为0.1 mol·L-1的FeSO4和CuSO4的混合溶液中滴加Na2S溶液,当加入Na2S溶液至出现两种沉淀,则溶液中c(Fe2+) : c(Cu2+) =___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性氢氧燃料电池为电源进行电解的实验装置如下图所示。下列说法正确的是( )

A. 燃料电池工作时,正极反应为:O2+ 2H2O + 4e-= 4OH-
B. 若a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出
C. 若a、b极都是石墨,在相同条件下a极产生的气体与电池中消耗的H2体积相等
D. 若a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
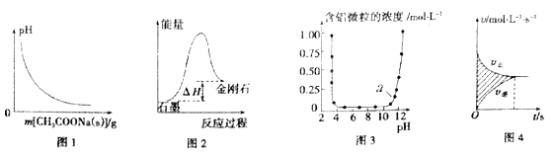
A. 图1表示向0.1mol/L CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化
B. 图2表示石墨转化为金刚石反应过程中的能量变化,可判断石墨比金刚石稳定
C. 图3表示Al3+与OH-反应时溶液中含铝微粒浓度变化曲线,图中a点溶液中大量存在Al3+
D. 图4表示某可逆反应的v-t曲线,图中阴影部分面积的含义是(v正-v逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂及锂盐具有的优异性能和特殊功能,在化工、电子、宇航、核能、能源等领域都得到广泛应用;锂元素更是被誉为“能源元素”。
Ⅰ、锂的原子结构示意图为___________;锂在空气中燃烧,发出浅蓝色的火焰,放出浓厚的白烟,生成相应氧化物____________(填化学式)。
Ⅱ、锂经常用于制作电池。锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。回答下列问题:
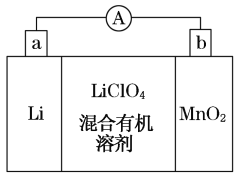
(1)外电路的电流方向是由________极流向________极。(填字母)
(2)电池正极反应式____________________________________。
(3)是否可用水代替电池中的混合有机溶剂?________(填“是”或“否”),用化学反应方程式解释原因______________________________________________。
Ⅲ、下面是从锂辉石(Li2O·Al2O3·SiO2)中提取锂的工业流程示意图。
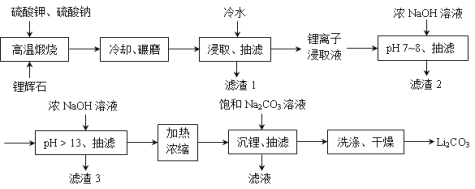
① 高温煅烧时的反应原理为:Li2OAl2O3SiO2+K2SO4= K2OAl2O3SiO2+Li2SO4;
Li2OAl2O3SiO2+Na2SO4= Na2OAl2O3SiO2+Li2SO4。
②锂离子浸取液中含有的金属离子为:K+、Na+、Li+、Fe3+、Fe2+、Al3+、Mn2+ 。
③几种金属离子沉淀完全的pH
金属离子 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 |
沉淀完全的pH | 4.7 | 9.0 | 3.2 | 10.1 |
④Li2SO4、Li2CO3在不同温度下的溶解度(g / 100g水)
温度 溶解度 | 10 | 20 | 50 | 80 |
Li2SO4 | 35.4 | 34.7 | 33.1 | 31.7 |
Li2CO3 | 1.43 | 1.33 | 1.08 | 0.85 |
(1)浸取时使用冷水的原因是______________________________________。
(2)滤渣2的主要成分为__________________。
(3)流程中分2次调节pH(pH7~8和pH > 13),有研究者尝试只加一次浓NaOH溶液使pH > 13,结果发现在加饱和碳酸钠溶液沉锂后,随着放置时间延长,白色沉淀增加,最后得到的Li2CO3产品中杂质增多。Li2CO3产品中的杂质可能是__________________,用离子方程式表示其产生的原因_____________________________。
(4)洗涤Li2CO3晶体使用_____________。(填“冷水”或“热水”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4N3(叠氮化铵)易发生爆炸反应: NH4N3![]() 2N2↑+2H2↑,NA为阿伏加德罗常数的值,下列说法正确的是
2N2↑+2H2↑,NA为阿伏加德罗常数的值,下列说法正确的是
A. 1.8gNH4+中含有的质子数为1NA
B. N2既是氧化产物,又是还原产物
C. 爆炸反应中,当转移4NA个电子时,产生89.6L (标准状态)混合气体
D. 6g的NH4N3晶体中含有的阴离子个数为0.3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com