
 ;悬浊液; (填“溶液”“胶体”或“悬浊液”).
;悬浊液; (填“溶液”“胶体”或“悬浊液”).分析 锌块加热融化,向锌液中鼓入M气体,使液态锌雾化,冷却得到锌粉,加水形成分散系,再通入二氧化硫反应得到ZnS2O4,加入NaOH溶液反应得到氢氧化锌沉淀、Na2S2O4,最后加入NaCl降低Na2S2O4的溶解度,析出Na2S2O4,溶液D中含有NaCl.
(1)保险粉遇水都会发生反应放出大量的热,甚至引起燃烧,故需密封、阴凉处保存;
(2)由锌块制备锌粉,增大锌反应的表面积;鼓入气体M为常见的化合物,可以是二氧化碳,冷却得到粒度约为180μm的锌粉,分散系A为悬浊液;
(3)流程②步骤中Zn与二氧化硫反应生成ZnS2O4;
(4)流程③是分离固体与溶液,分离方法为过滤、洗涤、干燥,为减少溶解导致的损失,用甲醇洗涤,过滤前加入NaClNa+ 浓度增大,便于Na2S2O4结晶析出;
(5)离子反应方程式为:S2O32-+Cr2O72-+6H+→2SO42-+2Cr3++3H2O;
(6)反应①与反应②中都生成亚硫酸氢钠,而反应②中还产生硫酸氢钠,硫酸氢钠在水溶液中完全电离产生氢离子、钠离子和硫酸根离子,可以根据检验产物中是否存在硫酸根离子,也可以将②的产物溶于水,有刺激性气味的气体二氧化硫产生.
解答 解:(1)保险粉遇水都会发生反应放出大量的热,甚至引起燃烧,故需密封、阴凉处保存,
故答案为:密封、阴凉处保存;
(2)由锌块制备锌粉的目的是:增大锌反应的表面积,加快化学反应速率;向锌液中鼓入M气体,使液态锌雾化,冷却得到粒度约为180μm的锌粉.鼓入气体M为常见的化合物,则M的化学式为CO2,电子式为 ,分散系A为悬浊液,
,分散系A为悬浊液,
故答案为: ;悬浊液;
;悬浊液;
(3)流程②步骤中Zn与二氧化硫反应生成ZnS2O4,反应方程式为:Zn+2SO2=ZnS2O4,
故答案为:Zn+2SO2=ZnS2O4;
(4)流程③是分离固体与溶液,分离方法为过滤、洗涤、干燥,为减少溶解导致的损失,用甲醇洗涤,过滤前加入NaCl增大Na+ 浓度,便于Na2S2O4结晶析出,
故答案为:过滤;甲醇;增大Na+ 浓度,便于Na2S2O4结晶析出;
(5)离子反应方程式为:S2O32-+Cr2O72-+6H+→2SO42-+2Cr3++3H2O,
故答案为:S2O32-+Cr2O72-+6H+→2SO42-+2Cr3++3H2O;
(6)反应①与反应②中都生成亚硫酸氢钠,而反应②中还产生硫酸氢钠,硫酸氢钠在水溶液中完全电离产生氢离子、钠离子和硫酸根离子,可以根据检验产物中是否存在硫酸根离子,具体操作为:取少许固体溶于水中,加入BaCl2溶液,有白色沉淀产生,则证明是②,
故答案为:取少许固体溶于水中,加入BaCl2溶液,有白色沉淀产生,则证明是②.
点评 本题考查物质准备工艺流程、陌生方程式的书写、物质的分离提纯等,为高考常见题型,注意对题目信息的获取与迁移应用,是对学生综合能力的考查,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 石油裂化、石油分馏、煤的气化、石油中提取石蜡都是化学变化 | |
| B. | 汽油、柴油、植物油都是碳氢化合物 | |
| C. | 实验事实证明乙酸乙酯中少量乙醇可以用水洗方法除去,其原理与溴水中加四氯化碳萃取溴类似 | |
| D. | 除去甲烷气体中的乙烯可以将混合气体通过盛有足量酸性高锰酸钾溶液的洗气瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大量排放含氮、磷的生活污水可使水体富营养化 | |
| B. | “曾青得铁,则化为铜”是描述金属间的置换反应 | |
| C. | 光化学姻雾的形成主要与硫氧化物的排放有关 | |
| D. | 硅是光伏太阳能电池的光电半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L的CH3Cl中所含质子数为26NA | |
| B. | 将100mL0.1mol/L的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒的数目为0.01NA | |
| C. | 常温下,1L0.1mol/L醋酸中含有的离子总数为0.2NA | |
| D. | 0.1molC2H2气体中,原子间含有的共用电子对数目为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
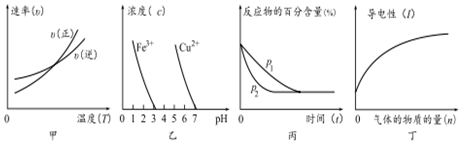
| A. | ①③ | B. | ②④ | C. | ③④ | D. | ①② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 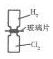 利用如图装置可将H2和Cl2均匀混合 | |
| B. | 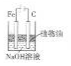 利用如图装置可以制备能较长时间存在的Fe(OH)2沉淀 | |
| C. |  利用如图装置加热蒸干NaCl溶液制备NaCl晶体 | |
| D. |  利用如图装置分离苯和甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
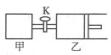 如图所示,关闭活塞,向甲、乙两刚性密闭容器中分别充入1mol A、2mol B,此时甲、乙的容积均为2L(连通管体积忽略不计).在T℃时,两容器中均发生下述反应:A(g)+2B(g)?2C(g)+3D(g),△H<0.达平衡时,乙的体积为2.6L,下列说法正确的是( )
如图所示,关闭活塞,向甲、乙两刚性密闭容器中分别充入1mol A、2mol B,此时甲、乙的容积均为2L(连通管体积忽略不计).在T℃时,两容器中均发生下述反应:A(g)+2B(g)?2C(g)+3D(g),△H<0.达平衡时,乙的体积为2.6L,下列说法正确的是( )| A. | 甲中反应的平衡常数小于乙 | |
| B. | 当乙中A与B的体积分数之比为1:2时,反应达到平衡状态 | |
| C. | 平衡时甲容器中A的物质的量小于0.55 mol | |
| D. | 若打开活塞K,达平衡时乙容器的体积为3.2 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L的O2和NO的混合物含有的分子数为0.5NA | |
| B. | 1mol的羟基与1mol的氢氧根离子所含电子数均为9NA | |
| C. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA | |
| D. | 在一定条件下,2mol浓H2SO4与足量的铜充分反应,转移的电子数目为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com