
| A. | 大量排放含氮、磷的生活污水可使水体富营养化 | |
| B. | “曾青得铁,则化为铜”是描述金属间的置换反应 | |
| C. | 光化学姻雾的形成主要与硫氧化物的排放有关 | |
| D. | 硅是光伏太阳能电池的光电半导体材料 |
分析 A.含氮、磷化合物的生活污水大量排放可促使水中肥料增多而导致水体富营养化;
B.“曾青得铁则化为铜”是指铁和硫酸铜溶液反应能生成铜和硫酸亚铁;
C.依据光化学烟雾成因解答;
D.依据硅的导电性介于导体与绝缘体之间解答.
解答 解:A.水体富营养化是指在人类活动的影响下,氮、磷等营养物质大量进入湖泊、河口、海湾等缓流水体,引起藻类及其他浮游生物迅速繁殖,水体溶解氧量下降,水质恶化,故A正确;
B.“曾青得铁则化为铜”的化学方程式为:Fe+CuSO4=Cu+FeSO4,由化学方程式可知,反应物和生成物都是一种单质和一种化合物,属于置换反应,故B正确;
C.光化学姻雾的形成主要与氮的氧化物的排放有关,故C错误;
D.硅导电性介于导体与绝缘体之间,是良好的半导体材料,是光伏太阳能电池的光电半导体材料,故D正确;
故选:C.
点评 本题考查较为综合,侧重于化学与生活、生产的考查,有利于培养学生的良好的科学素养,提高学生学习的积极性,题目难度不大,注意相关基础知识的积累.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 碳酸的电离方程式:H2CO3?2H++CO32- | |
| B. | 氯气通入水中:Cl2+H2O?2H++Cl-+ClO- | |
| C. | 往AgI悬浊液中滴加Na2S饱和溶液:2Ag+ (aq)+S2-(aq)=Ag2S(s) | |
| D. | 用醋酸除水垢:2CH3COOH+CaCO3=2CH3COO-+Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaBH4的电子式为 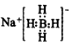 | |
| B. | 该反应在无水环境中进行 | |
| C. | NaBH4是很好的还原剂,常用于有机合成 | |
| D. | 1 molNaBH4与水充分反应可生成标况下44.8LH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下能导电 | B. | 水溶液呈碱性 | ||
| C. | 是共价化合物 | D. | 能与NaOH反应产生NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
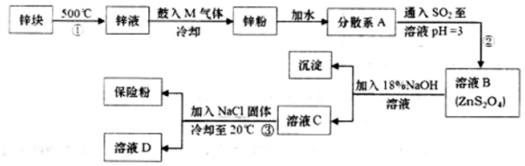
 ;悬浊液; (填“溶液”“胶体”或“悬浊液”).
;悬浊液; (填“溶液”“胶体”或“悬浊液”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只生成AgBr及AgI两种沉淀 | B. | 溶液中c(I-)≈1.0×10-9mol•L-1 | ||
| C. | 溶液中c(Br-)≈3.0×10-5mol•L-1 | D. | 溶液中c(Ag+)≈3.2×10-8mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com