
【题目】钼(Mo)是一种难熔稀有金属,我国的钼储量居世界第二。钼及其合金在冶金,农业、电器、化工、环保等方面有着广泛的应用。
(1)Mo可被发烟硝酸氧化,产物MoOF4和MoO2F2物质的量比为1∶1,完成下列方程式:____Mo+____HF+____HNO3=____ MoO2F2+____ MoOF4+____NO2↑+____ _________
(2)已知:①2Mo(s)+3O2(g)=2MoO3(s) ΔH1
②MoS2(s) +2O2(g)=Mo(s)+2SO2(g) ΔH2
③2MoS2(s)+7O2(g)=2MoO3(s)+4SO2(g) ΔH3
则ΔH3 =_________(用含ΔH1、ΔH2的代数式表示),在反应③中若有0.2mol MoS2参加反应,则转移电子_______________mol。
(3)密闭容器中用Na2CO3(S)作固硫剂,同时用一定量的氢气还原辉钼矿(MoS2)的原理是:MoS2(s)+4H2(g)+2Na2CO3(s)![]() Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) ΔH,实验测得平衡时的有关变化曲线如图所示:
Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) ΔH,实验测得平衡时的有关变化曲线如图所示:

①由图可知,该反应的ΔH__0(填“>”或“<”);P2__________0.1MPa(填“>”或“<”)。
②如果上述反应在体积不变的密闭容器中达平衡,下列说法错误的是______(选填编号)。
A.v正(H2)=v逆(H2O)
B.再加入MoS2,则H2转化率增大
C.容器内气体的密度不变时,一定达平衡状态
D.容器内压强不变时,一定达平衡状态
③由图可知M点时氢气的平衡转化率为____(计算结果保留0.1%)。
④平衡常数可用平衡分压代替平衡浓度计算,气体分压=气体总压×物质的量分数。求图中M点的平衡常数Kp=______(MPa)2
【答案】 2 6 12 1 1 12 9H2O △H1+2△H2 2.8 > > B 66.7% 0.01
【解析】(1)设生成MoOF4和MoO2F2均为1份,则消耗2份Mo,HF为6份,生成物应为H2O,设消耗硝酸为x份,生成水y份,则由物料平衡得3+x/2=y;3+y=x。解得x=12,y=9,所以方程式为2Mo+6HF+12HNO3= MoO2F2+ MoOF4+12NO2↑+6H2O;
(2)方程式②×2+方程式①=方程式③,所以ΔH3 =△H1+2△H2;反应中0.7molO2被还原,转移电子2.8mol;
(3)①温度越高,氢气含量越少,则说明反应为吸热反应,反应体系能量升高,故ΔH>0;
在相同温度下,P2条件下氢气含量大,说明此时反应向左进行,又方程式右端气体体积较左端大,增大压强会促进反应向左进行,则P2>P1=0.1MPa;
②A. 反应大道平衡时,氢气与水真气体积相同,A正确;B. 加入MoS2相当于减少了氢气的浓度,反应向左进行,氢气转化率下降,B错误;C. 容器内各种气体的量不发生变化,则反应达到平衡,C正确;D. 同理,容器内气体的总量不发生变化,说明反应没有朝任何方向进行,反应达到平衡,D正确。故选择B。
③ 方程式右端生成的气体为3份,是由2份氢气转化,则氢气的转化率为:2/(1+2)=66.7%;
④设氢气初始物质的量为x mol,则平衡时氢气的物质的量为0.333x mol,由0.667x mol氢气转化生成0.333x molCO和0.667x mol水蒸气,所以各物质的量分数分别为:n氢气=0.25,nCO=0.25,n水蒸气=0.5,所以Kp=![]() (MPa)2
(MPa)2


科目:高中化学 来源: 题型:
【题目】某小组利用如图装置,用苯与溴在FeBr3催化作用下制备溴苯:

苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/°C | 80 | 59 | 156 |
水中溶解性 | 微溶 | 微溶 | 微溶 |
实验过程:在a中加入15mL无水苯和少量铁屑,在b中小心加入4.0mL液态溴。向a中滴入几滴溴。反应剧烈进行。反应停止后按如下流程分离提纯产品:

(1)烧瓶中有大量红棕色蒸气,试管d中的现象是:①______________;② 蒸馏水逐渐变成黄色。c的作用是___________________________________。
(2)分离提纯时,操作Ⅰ为______________,操作Ⅱ为_________________。
(3)“水洗”需要用到的玻璃仪器是_________、烧杯,向“水洗”后所得水相中滴加KSCN溶液,溶液变红色。推测水洗的主要目的是除去__________________。
(4)“NaOH溶液洗”时反应的化学方程式是________________________。
(5)已知苯与溴发生的是取代反应,推测反应后试管d中液体含有的两种大量离子是H+和Br-,设计实验方案验证推测。(限选试剂:Mg、CCl4、AgNO3aq、H2O)
实验步骤 | 预期现象 | 结论 |
步骤1:将试管d中液体转入分液漏斗, __________________________________,将所取溶液等分成两份,置于A、B两试管中,进行步骤2、3。 | ||
步骤2: 。 | 证明有 存在 | |
步骤3: 。 | 证明有 存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2Y2-是乙二胺四乙酸根(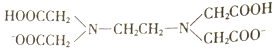 )的简写,可与多种金属离子形成络合物。
)的简写,可与多种金属离子形成络合物。
I. H2Y2-与Fe2+形成的络合物FeY2-可用于吸收烟气中的NO。其吸收原理:
FeY2-(aq)+NO(g)![]() FeY2-(NO)(aq) △H<0
FeY2-(NO)(aq) △H<0
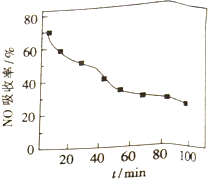
(1)将含NO的烟气以一定的流速通入起始温度为50℃的FeY2-溶液中。NO吸收率随通入烟气的时间变化如右图。时间越长,NO吸收率越低的原因是_________。
(2)生成的FeY2-(NO)(aq)可通过加入铁粉还原再生,其原理:FeY2-(NO)(aq)+Fe+H2O→FeY2-(aq)+Fe(OH)2+NH3(未配平)。
若吸收液再生消耗14g铁粉,则所吸收的烟气中含有NO的物质的量为_______。
II.络合铜(CuY2-)废水的处理一直是环境工程领域的研究热点。
(1)H2Y2-与Cu2+、Fe3+、Ca2+络合情况如下表:
络合反应 | lgK(K为平衡常数) |
Cu2++H2Y2- | 18.8 |
Fe3++H2Y2- | 25.1 |
Ca2++H2Y2- | 10.7 |
①表中最不稳定的金属络合物是_____(填化学式)。向含有络合铜(CuY2-)废水中加入一种黄色的盐溶液A可解离出Cu2+,则盐A中阳离子为________(填化学式)。
②调节pH可将解离出的Cu2+转化为Cu(OH)2沉淀,若要使c(Cu2+)≤2.2×10-4mol/L,pH应不低于________(常温下Ksp[Cu(OH)2]= 2.2×10-20)。
(2)羟基自由基(-OH)、Na2FeO2都可氧化络合铜中的Y4-而使Cu2+得到解离。
①酸性条件下,-OH可将Y4-(C10H12O8N24-)氧化生成CO2、H2O、N2。该反应的离子方程式为___________________。
②Na2FeO4在酸性条件下不稳定。用Na2FeO4处理后的废水中Cu2+的浓度与pH的关系如右图。pH越大,/span>废水处理效果越好,这是因为______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:T℃时,Ksp(CaSO4)=4.90×10-5、Ksp (CaCO3)=2.8×10-9 Ksp(PbCO3)=8.4×10-14,三种盐的沉淀溶解平衡曲线如图所示,pM=-lgc(阴离子)、pN=-lgc(阳离子)。下列说法错误的是
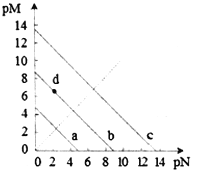
A. a线是CaSO4沉定溶解平衡曲线
B. T℃时,向10mL水中加入CaCO3和PbCO3至二者均饱和,溶液中c(Ca2+)∶c(Pb2+)=
C. d点表示CaCO3的饱和溶液。且c(Ca2+)<c(CO32-)
D. T℃时,向CaSO4沉淀中加入1mol·L-1的Na2CO3溶液,CaSO4沉淀会转化为CaCO3沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物比卡鲁安(G)可以通过以下方法合成:

(1)B 中的含氧官能团名称为__________________;
(2)B→C 的反应类型为___________________;
(3)写出同时满足下列条件的 D 的一种同分异构体的结构简式:__________________;
①有苯环;②能使溴的 CCl4 溶液褪色;③分子中有 2 种不同化学环境的氢
(4)合成 F 时还可能生成一种副产物 X,X 的结构简式为___________________;
(5)已知 : 苯胺 (![]() ) 易被氧化,请以甲苯和甲醇为原料制备
) 易被氧化,请以甲苯和甲醇为原料制备 。_____________________
。_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业尾气中氮氧化物通常采用氨催化吸收法,其原理是NH 3 与NOx在催化剂作用下反应生成无毒的物质。某校活动小组同学采用以下装置和步骤模拟工业上氮氧化物 的处理过程。

I.探究制取NH 3 的方法
(1)B装置的名称:______________
(2)在上述装置中,H能快速、简便制取,装置中需要添加的反应试剂为_________ 。
(3)为探究更好的实验效果,活动小组同学采用上述C装置来制取氨气,在控制实验条件相同的情况下,获得下表中实验数据。
分析表中数据,你认为哪种方案制取氨气的效果最好________(填序号),从该方案选择的原料分析制气效果好的可能原因是________,__________。
试剂组合序号 | 固体试剂 | NH 3 体积(mL) | |
a | 6.0gCa(OH) 2 过量 | 5.4gNH 4 Cl | 1344 |
b | 5.4g(NH 4 ) 2 SO 4 | 1364 | |
c | 6.0gNaOH过量 | 5.4gNH 4 Cl | 1568 |
d | 5.4g(NH 4 ) 2 SO 4 | 1559 | |
e | 6.0gCaO过量 | 5.4gNH 4 Cl | 1753 |
f | 5.4g(NH 4 ) 2 SO 4 | 1792 | |
II.模拟尾气处理
活动小组同学选用上述部分装置,按下列顺序连接成模拟尾气处理装置进行实验。
(1)请从上述装置中选择你认为合理的进行补充(所选装置不能重复)_______。
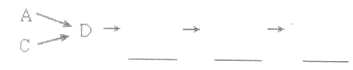
(2)A中反应的离子方程式为__________________________
(3)D装置的作用有:_____________、____________、_____________。
(4)D装置中的液体还可换成(填序号)。
A.H 2 O B.CCl 4 C.浓H 2 SO 4 D.CuSO 4 溶液
(5)该小组同学所设计的模拟尾气处理装置中还存在一处明显的缺陷是___________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香烟中含有微量的210Po,吸烟者会将210Po直接吸入肺部,危害人体健康。210Po中的210代表 ( )
A. 质子数 B. 中子数 C. 相对原子质量 D. 质量数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.电离是指电解质在电流作用下解离出离子的过程
B.溶于水后能电离出H+的化合物都是酸
C.氯化氢溶于水能导电,因此氯化氢是电解质
D.氯化钠固体不导电,所以氯化钠不是电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com