
二氯化硫(S2Cl2)是广泛用于橡胶工业的硫化剂;其分子结构如右图所示。常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。下列说法中错误的是( )

A.S2Cl2的电子式为
B.S2Cl2为含有极性键和非极性键的非极性分子
C.S2Br2与S2Cl2结构相似,熔沸点:S2Br2>S2Cl2
D.S2Cl2与H2O反应的化学方程式可能为:2S2Cl2 +2H2O===SO2↑+3S↓+4HCl
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源:2016届山西省高三第二轮限时训练四化学试卷(解析版) 题型:选择题
从某些性质看:NH3和H2O,NH2-和OH-,N3-和O2-两两相似,据此判断下列反应正确的是
①2Na+2NH3=2NaNH2+H2↑ ②CaO+2NH4Cl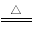 CaCl2+2NH3↑+H2O
CaCl2+2NH3↑+H2O
③3Mg(NH2)2 Mg3N2+4NH3↑ ④NH4Cl+NaNH2
Mg3N2+4NH3↑ ④NH4Cl+NaNH2 NaCl+2NH3↑
NaCl+2NH3↑
A.③ B.② C.②③ D.①②③④
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高一下期中化学试卷(解析版) 题型:选择题
下列物质进行一氯取代反应后,生成4种沸点不同的有机产物的是 ( )
A. 2,2-二甲基丁烷 B. 2,2-二甲基-3-乙基戊烷
C. 2,3-二甲基戊烷 D. 2,2,3-三甲基戊烷
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高一下期中化学试卷(解析版) 题型:选择题
已知aAn+、bB(n+1)+、cCn-、dD(n+1)-是具有相同电子层结构的短周期元素形成的简单离子。下列叙述正确的是( )
A.原子半径:C>D>A>B B.原子序数:b>a>d>c
C.离子半径:D>C>A>B D.单质还原性:A>B>C>D
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高二下期中化学试卷(解析版) 题型:选择题
三氯化氮(NCl3)是一种淡黄色的油状液体,测得其分子具有三角锥形结构。则下面对于NCl3的描述不正确的是( )
A.它是一种极性分子 B.它的挥发性比NBr3要大
C.它还能再以配位键与Cl-结合 D.已知NBr3对光敏感,所以NCl3对光也敏感
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高二下期中化学试卷(解析版) 题型:选择题
下面关于SiO2晶体网状结构的叙述正确的是( )
A.最小的环上,有3个Si原子和3个O原子
B.最小的环上,Si和O原子数之比为1:2
C.最小的环上,有6个Si原子和6个O原子
D.存在四面体结构单元,O处于中心,Si处于4个顶角
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高二下期中化学试卷(解析版) 题型:选择题
以下有关元素性质的说法不正确的是( )
A. 具有下列电子排布式的原子中,①1s22s22p63s23p2②1s22s22p3 ③1s22s22p2 ④1s22s22p63s23p4,原子半径最大的是①
B. 下列原子的外围电子排布中,①3s23p1 ②3s23p2③3s23p3 ④3s23p4,对应的第一电离能最大的是③
C. ①Na、K、Rb ②N、P、As ③O、S、Se ④Na、P、Cl,元素的电负性随原子序数的增加而递增的是④
D. 某元素的逐级电离能(kJ/mol)分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时最可能生成的阳离子是③ ①X+ ②X2+ ③X3+ ④X4+
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江大庆市高一下期中化学试卷(解析版) 题型:选择题
短周期元素X、Y的原子序数相差2,下列叙述正确的是( )
A.X与Y不可能位于同一周期
B.X与Y不可能形成原子个数比为1:1型离子化合物
C.X离子与Y离子电子层结构可以相同,也可以不同
D.X与Y形成的共价化合物中,各原子最外层一定满足8电子的稳定结构
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一下期中化学试卷(解析版) 题型:填空题
(l)由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
①装置乙中正极的电极反应式是 。
②四种金属活动性由强到弱的顺序是 。
(2)由Zn一Cu一硫酸溶液组成的原电池,工作一段时间后锌片的质量减少了6.5g.回答下列问题:溶液中的H+移向 (填“正极”或“负极’) 。负极的电极反应式是 , 标准状况下生成 L气体。
(3)断开1 mol H一H键、1 mol N一H键、1 mol N≡N 键分别需要吸收能量为436KJ、391KJ、946KJ,求:H2与N2反应生成0.5 molNH3填(“吸收”或“放出”)能量 KJ。
(4)原子序数大于4的主族元素A和B的离子分别为Am+和Bn-,已知它们的核外电子排布相同,据此推断:
① A和B所属周期数之差为(填具体数字) 。
② A和B的核电荷数之差为(用含m或n的式子表示) 。
③ B和A的族序数之差为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com