
| A、标准状况下,22.4L乙醇中含有的氧原子数为NA |
| B、标准状况下,22.4L37Cl2中所含中子数为4NA |
| C、将0.1mol氯化铁溶于1L水中,所得溶液含有0.1NA个Fe3+ |
| D、25℃时,pH=13的1.0LBa(OH)2溶液中含有OH-数目为0.1NA |


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案科目:高中化学 来源: 题型:
| A、2.24LHCl溶于水,溶液中H+数为NA |
| B、100g98%的浓硫酸中含氧原子个数为4NA |
| C、2.3gNa和足量的O2完全反应,在常温和燃烧时,转移电子数均为0.1NA |
| D、1molFeCl3跟水完全反应转化为氢氧化铁胶体,其中胶体粒子的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:

 ,则E的结构简式为
,则E的结构简式为查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱酸 | CH3COOH | HCN |
| pH | 3.4 | 5.6 |
| A、相同pH的两种酸溶液中,CH3COOH溶液中水电离的试c(H+)浓度较大 |
| B、物质的量浓度相同的CH3COONa与NaCN溶液中,CH3COONa溶液pH较大 |
| C、等体积pH相同的两种酸溶液,分别滴加NaOH溶液至恰好中和,消耗等量的NaOH |
| D、HCN的电离平衡常数(Ka)与CN-的水解平衡常数(K)存在如下关系:Ka?K=KW |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/°C | K1 | K2 |
| 500 | 1.00 | 3.15 |
| 700 | 1.47 | 2.26 |
| 900 | 2.40 | 1.60 |

查看答案和解析>>
科目:高中化学 来源: 题型:
 根据如图可以写出热化学方程式As2O5(s)=As2O3(s)+O2( g)△H=a kJ/mol.则a为( )
根据如图可以写出热化学方程式As2O5(s)=As2O3(s)+O2( g)△H=a kJ/mol.则a为( )| A、+1533.8 |
| B、-1533.8 |
| C、+295.4 |
| D、-295.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| T(℃) | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
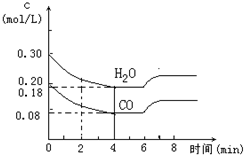
查看答案和解析>>
科目:高中化学 来源: 题型:
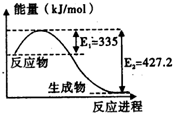 (1)已知:C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol
(1)已知:C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol| 1 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、石灰乳与Na2CO3溶液混合:Ca 2++C
| ||||
B、向沸水中滴加FeCl3溶液并加热制备Fe(OH)3胶体:Fe3++3H2O
| ||||
C、向CH2BrCOOH中加足量的氢氧化钠溶液并加热:CH 2BrCOOH+2OH-
| ||||
| D、FeO与稀硝酸反应:FeO+6H++NO3-=Fe3++NO↑+3H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com