
| A、0.1 mol?L-1的Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) |
| B、将pH=6的H2SO4稀释1000倍后,c(H+)=2 c(SO42-) |
| C、浓度分别为0.1 mol?L-1和0.01 mol?L-1的CH3COOH溶液中:c(CH3COO-)前者是后者的10倍 |
| D、浓度均为0.1 mol?L-1的NaCN溶液和CH3COONa溶液中,c(CN-)<c(CH3COO-) |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 1000 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、O2是还原产物 |
| B、NaOH是氧化产物 |
| C、Na2O2是氧化剂,水是还原剂 |
| D、Na2O2中,-1价的氧既得电子,又失电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、用小苏打治疗胃酸过多:
| ||
B、用食醋除去水瓶中的水垢:
| ||
| C、漂白粉溶液中加入稀盐酸:H++ClO-=HClO | ||
| D、向澄清石灰水中通入过量的二氧化碳气体:Ca2++2OH-+CO2=CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、根据酸分子中含有的H原子个数将酸分为一元酸、二元酸、多元酸 |
| B、NO2为酸性氧化物,Na2O2为碱性氧化物,Mg3N2为盐 |
| C、Na2O为电解质,因为Na2O的水溶液能导电 |
| D、在熔化状态下能导电的化合物一定是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| CH4 | CH2O | CH2O2 | CH4O | C2H6 | C2H4O | C2H4O2 | C2H6O |
| A、②⑤ | B、①③④ |
| C、③④ | D、②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、500mL1mol/LFe2(SO4)3溶液和250mL3mol/L的Na2SO4溶液所含硫酸根离子的物质的量浓度相等 |
| B、因为酸性H2SO3>H2CO3,所以非金属性S>C |
| C、1.2gNaHSO4晶体中阳离子和阴离子的总数为0.03NA |
| D、分别为7.8g的Na2S和Na2O2中含有的阴离子数分别为0.1NA、和0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、15.9 g |
| B、21.2 g |
| C、88.2 g |
| D、条件不够,无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:
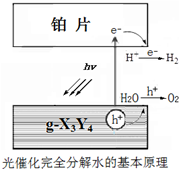 原子序数依次增大的四种短周期元素X、Y、Z、W,其相关信息如下表:
原子序数依次增大的四种短周期元素X、Y、Z、W,其相关信息如下表:| 元素 | 相关信息 |
| X | X的一种同素异形体是一种最软的矿物,常用于制造电极 |
| Y | Y的氢化物常温下呈气态,其水溶液能使酚酞试液变红 |
| Z | Z的最高价氧化物的水化物,在熔化状态下电离出离子数和电荷数均相等的阴阳离子 |
| W | W的基态原子的每个原子轨道均有电子填充,但只有一个未成对电子 |
| 1 |
| 2O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com