
| m |
| M |
| N |
| NA |
| V |
| Vm |
| n |
| V |
| m |
| M |
| 28g |
| 40g/mol |
| N |
| NA |
| 3.01×1023 |
| 6.02×1023/mol |
| V |
| Vm |
| 67.2L |
| 22.4L/mol |
| n |
| V |
| 3mol |
| 0.5L |


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
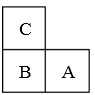 如图所示:A、B、C是短周期的三种相邻元素.A、B同周期,B、C同主族;这三种元素的质子数之和为38;最外层电子数之和为16.则它们的元素符号分别为:A
如图所示:A、B、C是短周期的三种相邻元素.A、B同周期,B、C同主族;这三种元素的质子数之和为38;最外层电子数之和为16.则它们的元素符号分别为:A查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
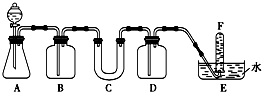 在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.请选择适当的化学试剂和实验用品,用图中的实验装置进行试验,证明过氧化钠可作供氧剂.
在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.请选择适当的化学试剂和实验用品,用图中的实验装置进行试验,证明过氧化钠可作供氧剂.查看答案和解析>>
科目:高中化学 来源: 题型:
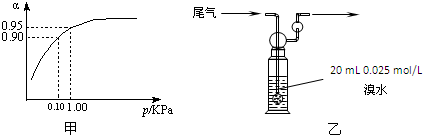
| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 2mol SO2、1mol O2 | 2mol SO3 | m mol SO2、n mol O2、 p mol SO3 |
| c(SO3)/mol?L-1 | 1.4 | 1.4 | 1.4 |
| 能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
| SO2或SO3的转化率 | α1 | α2 | 12.5% |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com