
【题目】“纳米材料”是指直径从几纳米至几十纳米的材料,目前已广泛应用于催化剂及军事技术中,如果将纳米材料分散到液体分散剂中,所得混合物( )
A.不能透过滤纸 B.一定是浊液
C.一定是溶液 D.有丁达尔效应
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列坐标图均涉及平衡原理,其中相关表述正确的是

A.图①表示室温下,用0.1mol·L-1氨水吸收HCl气体时,溶液的粒子浓度随吸收HCl的变化,实线表示c(NH3·H2O),虚线表示c(NH4+),处于M点时溶液呈中性
B.图②表示2SO2(g)+O2(g) ![]() 2SO3(g) △H<0正逆反应的平衡常数K随温度的变化
2SO3(g) △H<0正逆反应的平衡常数K随温度的变化
C.图③表示反应2NH3(g) ![]() 3H2(g)+N2(g)在恒温恒压装置中达平衡时,N2的物质的量与通入NH3的物质的量的变化关系
3H2(g)+N2(g)在恒温恒压装置中达平衡时,N2的物质的量与通入NH3的物质的量的变化关系
D.图④表示AgCl(s) ![]() Ag+(aq)+Cl-(aq)的离子的浓度关系,当处于b点时,蒸发部分的水后,可以到达平衡线的a点处
Ag+(aq)+Cl-(aq)的离子的浓度关系,当处于b点时,蒸发部分的水后,可以到达平衡线的a点处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A. 同浓度、同体积的强酸与强碱溶液混合后,溶液的 pH 一定等于 7
B. 0.1 mol·L-1 NH4Cl 溶液与 0.1 mol·L-1 氨水等体积混合(pH>7):c(NH3 ·H2O)>c(NH4+)>c(Cl-)>c(OH-)
C. 0.1 mol AgCl 和 0.1 mol AgBr 混合后加入水中,所得溶液 c(Cl-)=c(Br-)
D. 向 0.10 mol·L-1Na2SO3溶液中通 SO2 气体至溶液 pH=7:c(Na+) = 2c(SO32-)+c(HSO3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家最近又发现了一种新能源——“可燃冰”。它的主要成分是甲烷分子的结晶水合物(CH4·nH2O)。其形成过程是:埋于海底地层深处的大量有机质在缺氧环境中,厌氧型细菌把有机质分解,最后形成石油和天然气,其中许多天然气被包进水分子中,在海底的低温与高压下形成了类似冰的透明晶体,这就是“可燃冰”。这种“可燃冰”的晶体类型是( )
A. 离子晶体 B. 分子晶体 C. 原子晶体 D. 金属晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是电解 CuCl2溶液的装置,其中 c、d 为石墨电极。则下列有关的判断正确的是

A. a 为负极、b 为正极 B. a 为阳极、b 为阴极
C. 电解过程中,d 电极质量增加 D. 电解过程中,氯离子浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有易溶强电解质的混合溶液10 L,其中可能含K+、Ba2+、Na+、![]() 、Cl、
、Cl、![]() 、
、![]() 、OH中的几种,向其中通入CO2气体,产生沉淀的量与通入CO2的量之间的关系如下图所示:
、OH中的几种,向其中通入CO2气体,产生沉淀的量与通入CO2的量之间的关系如下图所示:
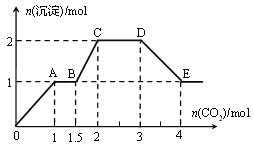
下列说法正确的是
A.该溶液中能确定存在的离子是Ba2+、![]() 、
、![]()
B.肯定不存在的离子是![]() 、OH
、OH
C.若不能确定的离子中至少还存在一种阳离子,则该离子的最小浓度为0.2 mol·L1
D.OA 段反应的离子方程式:2![]() +CO2+3H2O===2Al(OH)3↓+
+CO2+3H2O===2Al(OH)3↓+![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将100 mL 0.30 mol·L-1的Na2SO4溶液和50 mL 0.20 mol·L-1的Al2(SO4)3溶液混合后,所得溶液中SO42-的物质的量浓度为
A. 0.20 mol·L-1 B. 0.25 mol·L-1
C. 0.40 mol·L-1 D. 0.50 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20.00mL 0.1000mol·L-1(NH4)2SO4溶液中逐滴加入0.2000mol·L-1NaOH时,溶液的pH与所加NaOH溶液体积的关系如下图所示(不考虑挥发)。下列说法正确的是

A. 点a所示溶液中:c(NH4+)>c(SO42-)>c(OH-)>c(H+)
B. 点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH-)
C. 点c所示溶液中:c(SO42-)+c(H+)=c(NH3H2O)+c(OH-)
D. 点d所示溶液中:c(SO42-)>c(NH3H2O)>c(NH4+)>c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com