
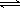 2SO3(g)����H=��196 kJ/mo1��850Kʱ����2L�̶��ݻ����ܱ������г���2mol SO2��2mol O2��10���Ӻ�ﵽƽ�⣬SO2Ũ�Ⱥ�ʱ���ϵ��ͼ��
2SO3(g)����H=��196 kJ/mo1��850Kʱ����2L�̶��ݻ����ܱ������г���2mol SO2��2mol O2��10���Ӻ�ﵽƽ�⣬SO2Ũ�Ⱥ�ʱ���ϵ��ͼ��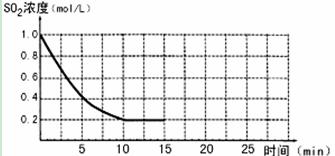



 һ����ʦ�����Ծ�ϵ�д�
һ����ʦ�����Ծ�ϵ�д� �����Ծ���Ԫ���Ծ�ϵ�д�
�����Ծ���Ԫ���Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�����ķ�Ӧ���ʣ�0.5mol/��L��min�� |
| B������ķ�Ӧ���ʣ�0.5mol/��L��min�� |
| C�����������ķ�Ӧ���ʣ�0.5mol/��L��min�� |
| D�������ķ�Ӧ���ʣ�0.5mol/��L��min�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
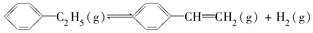 ����H��a kJ��mol��1����һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ�IJ������ݼ��±���
����H��a kJ��mol��1����һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ�IJ������ݼ��±���| ʱ��/min | 0 | 10 | 20 | 30 | 40 |
| n(�ұ�)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
| n(����ϩ)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��v (N2)=0��05mol��L��1��s��1 | B��v (H2)=0��3mol��L��1��min��1 |
| C��v (N2)=0��2 mol��L��1��min��1 | D��v (NH3)=0��3 mol��L��1��min��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��0.60mol��L | B��0.50mol��L | C��0.45mol��L | D��0.55mol��L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A��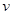 (W)��3 (W)��3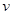 (Z) (Z) | B��2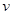 (X)��3 (X)��3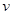 (Z) (Z) |
C��2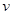 (X)�� (X)��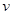 (Y) (Y) | D��3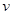 (W)��2 (W)��2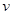 (X) (X) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2Z(g)+2W(g)��2L�ܱ������н��У�5min��Y������0.5mol����˷�Ӧ������vΪ( )
2Z(g)+2W(g)��2L�ܱ������н��У�5min��Y������0.5mol����˷�Ӧ������vΪ( )| A��v(X)=0.05mol��L�C1��min�C1 | B��v(Z)=0.10mol��L�C1��min�C1 |
| C��v(Y)=0.10mol��L�C1��min�C1 | D��v(W)=0.05mol��L�C1��min�C1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
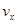 ����x����ij��Ӧ���������)֮��Ĺ�ϵ����ȷ���ǣ��� ��
����x����ij��Ӧ���������)֮��Ĺ�ϵ����ȷ���ǣ��� �� A��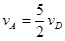 | B��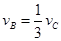 �� �� | C��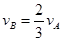 �� �� | D��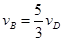 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com