
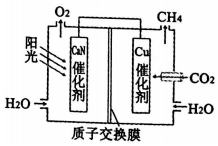
| A. | 该装置是原电池 | |
| B. | GaN催化剂表面发生氧化反应,溶液酸性增强 | |
| C. | 电子从GaN催化剂经导线转移到Cu催化剂 | |
| D. | Cu催化剂表面的反应是CO2+8H++8e-=CH4+2H2O |
分析 根据装置图中物质变化,判断催化剂GaN为负极电极反应:2H2O-4 e-═O2+4H+,酸性增强;催化剂Cu为正极,电极反应:CO2+8H++8e-═CH4+2H2O,酸性减弱,总的电池反应为2H2O+CO2═CH4+2O2,该过程把太阳能转化为化学能.
解答 根据装置图中电子的流向,判断催化剂GaN为负极电极反应:2H2O-4 e-═O2+4H+,酸性增强;催化剂Cu为正极,电极反应:CO2+8H++8e-═CH4+2H2O,酸性减弱,总的电池反应为2H2O+CO2═CH4+2O2,该过程把太阳能转化为化学能;
A、过程中是光合作用,太阳能转化为化学能,故A错误;
B、催化剂GaN附近酸性增强,催化剂Cu附近酸性减弱,故B正确;
C、等着从负极GaN催化剂经导线转移到Cu催化剂,故C正确;
D、催化剂Cu表面的反应是通入二氧化碳,酸性条件下生成CH4,电极反应为:CO2+8H++8e-═CH4+2H2O,故D正确;
故选A.
点评 本题考查了能量转化关系的分析应用,原电池原理的分析判断,题目难度中等.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 强电解质 | C12H22O11 | BaSO4 | NaOH | H3PO4 |
| 弱电解质 | CH3COOH | HF | NH3•H2O | HClO |
| 非电解质 | S | CO2 | 盐酸 | C2H5OH |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用排饱和氯化铵溶液的方法收集氨气 | |
| B. | 用重结晶的方法除去BaSO4固体中混有的NaCl | |
| C. | 将碳酸钙置于蒸发皿中高温灼烧可得到氧化钙 | |
| D. | 将硫酸铜溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到胆矾晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向酸性KlO3溶液中加入KI溶液:5I-+IO3-+3H2O═3I2+6OH- | |
| B. | FeS除去污水中的微量Hg2+:FeS+Hg2+═HgS+Fe2+ | |
| C. | NaHCO3溶液呈碱性:HCO3-+H2O?CO32--+H3O+ | |
| D. | AlCl3溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 二氧化硫在生产和生活中有重要的应用.
二氧化硫在生产和生活中有重要的应用. S+2CO2.
S+2CO2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使石蕊显红色的溶液:K+、Mg2+、HCO3-、SO42- | |
| B. | 水电离出来的 c(H+)=10-13mol•L-1的溶液:NH4+、Fe2+、NO3-、Cl- | |
| C. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液:K+、Fe3+、Cl-、SO42- | |
| D. | 加入铝片能放出H2的溶液:Na+、CH3COO-、Cu2+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
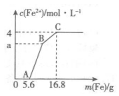 某100mL稀溶液中只含有Fe3+、Cu2+、H+、NO3-四种离子,向其中逐渐加入铁粉,溶液中Fe2+的浓度和加入铁粉的质量的关系如图所示,若整个反应过程中溶液的体积不发生变化,则下列说法中不正确的是( )
某100mL稀溶液中只含有Fe3+、Cu2+、H+、NO3-四种离子,向其中逐渐加入铁粉,溶液中Fe2+的浓度和加入铁粉的质量的关系如图所示,若整个反应过程中溶液的体积不发生变化,则下列说法中不正确的是( )| A. | 原溶液的c(H+)=4 mol•L-1 | |
| B. | 若a=3,则原溶液中c(Cu2+)=1 mol•L-1 | |
| C. | 原溶液中的c(NO3)=7 mol•L-1 | |
| D. | BC段发生反应的离子方程式为Cu2++Fe═Fe2++Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量盐酸观察是否有气体产生 | |
| B. | 加热观察是否有气体产生 | |
| C. | 加入过量盐酸观察是否有气体产生 | |
| D. | 加入少量碳酸氢钙溶液观察是否有沉淀产生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com