
����Ŀ����1�����и�ͼ���ܱ�ʾ����ķ��ӽṹ,��Ҫ��ش���������:

��������һ�ָ��ܷ�ӳ����ʵ����״��________ (����ĸ,��ͬ)��
a.�� b.�� c.�� d.��
��������ʵ��֤�������������������ṹ����_____��
a.CH3Clֻ����һ������ b.CH2Cl2ֻ����һ������
c.CHCl3ֻ����һ������ d.CCl4ֻ����һ������
��2���������е�̼ԭ������ԭ�ӽ�ϵķ�ʽ��_____��
a.�γ�4�Թ��õ��Ӷ�
b.ͨ��1�����ۼ�
c.ͨ��2�����ۼ�
d.ͨ�����Ӽ����ۼ�
��3������ĵ���ʽΪ__________������ʽΪCmH20��������mΪ________������ʽΪC8Hn��������nΪ________����CO2�ܶ�(ͬ��ͬѹ)��ͬ����������ʽΪ____����������������Ϊ1mol��������O2��ȼ�գ�����O2������_____��
��4����CH4��C2H6��C3H8��C4H10��������Ϊ1g��������O2��ȼ�գ�����O2������_____��
���𰸡�d b b ![]() 9 18 C3H8 C9H20 CH4
9 18 C3H8 C9H20 CH4
��������
��1�����⼸����ʽ�У����ӽṹʾ��ͼ�����ģ�ͼ����ģ�;��ܷ�ӳ��������ӵĿռ�ṹ������ʽֻ��ӳԭ���������ӵijɼ�����������пռ����ģ��������ı������ԭ�ӡ�̼ԭ�ӵ�λ�ü���ռ�������ʴ�Ϊ��d��
�����ۼ�����ƽ�湹�ͻ����������幹�ͣ�CH3Cl��CHCl3��CCl4��ֻ��һ�ֽṹ����CH2Cl2���������幹����ֻ��һ�ֽṹ������ƽ�湹���п��������ֽṹ������CH2Cl2ֻ����һ�����ʣ������жϼ���ӦΪ��������ṹ��������ƽ��ṹ���ʴ�Ϊ��b��
��2���������е�̼ԭ���������4�����ӣ�����ԭ�������ֻ��1�����ӣ�����̼ԭ������ԭ�ӽ�ϵķ�ʽֻ���γ�һ�Թ��õ��Ӷԣ���һ�����ۼ����ʴ�Ϊ��b��
��3�����������̼ԭ������ԭ��ͨ��һ�Թ��õ��Ӷ������ӣ�̼ԭ����̼ԭ��֮��Ҳͨ��һ�Թ��õ��Ӷ������ӣ���������ĵ���ʽΪ![]() ��������ͨʽΪCnH2n+2������ʽΪCmH20��������mΪ
��������ͨʽΪCnH2n+2������ʽΪCmH20��������mΪ![]() =9������ʽΪC9H20������ʽΪC8Hn��������nΪ
=9������ʽΪC9H20������ʽΪC8Hn��������nΪ![]() =18������ʽΪC8H18�����ݰ����ӵ����ɿ�֪��ͬ��ͬѹ�£��ܶ�֮�ȵ���Ħ������֮�ȣ�������CO2�ܶ���ͬ��������Ħ������Ϊ44g/mol���������̼ԭ������x����������ͨʽ����ʽ12x+2x+2=44�����x=3�������ʽΪC3H8��1mol C2H6��C9H20��C8H18��C3H8��������������ȼ�գ����������ֱ�Ϊ3.5mol��14mol��12.5mol��5mol��������������������C9H20��
=18������ʽΪC8H18�����ݰ����ӵ����ɿ�֪��ͬ��ͬѹ�£��ܶ�֮�ȵ���Ħ������֮�ȣ�������CO2�ܶ���ͬ��������Ħ������Ϊ44g/mol���������̼ԭ������x����������ͨʽ����ʽ12x+2x+2=44�����x=3�������ʽΪC3H8��1mol C2H6��C9H20��C8H18��C3H8��������������ȼ�գ����������ֱ�Ϊ3.5mol��14mol��12.5mol��5mol��������������������C9H20��
��������������![]() ��9��18��C3H8��C9H20��
��9��18��C3H8��C9H20��
��4��CH4��C2H6��C3H8��C4H10��������������������Ӵ�СΪCH4��C2H6��C3H8��C4H10��������ͬʱ����������Ԫ�ص���������Խ����ȫȼ��ʱ��������Խ�࣬������������������CH4���ʴ�Ϊ��CH4��


 ������ҵ��ͬ����ϰ��ϵ�д�
������ҵ��ͬ����ϰ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о���ѧϰС����Na2SO3��������Һ(������ˮ�����1��1)�Ʊ�SO2����������̽��ʵ�顣

��1��D�е�ʵ��������_____________��C��E����Һ����ɫ���ֱ�����SO2________��_______���ʡ�
��2�����ڷ����л����ռ�SO2�Լ�β������װ��(������Լ�)��___________
��3���о�С�鷢��B���а�ɫ������Ϊ��������������ʣ��о�С����B�м������ϡ���ᣬ���� ���ܽ⣬����Ϊ���µij�������__________���γɸó����ķ�Ӧ����ʽ�У�_________________________________________________________________________________
Ϊ�˽�һ����֤����ԭ���о�С����ȡBaC12��Һ��������У���ȴ�� ʱ����������Һ�⣬Ȼ����ͨSO2��������ֳ��������٣����������� �ǡ��о�С��Ľ�Aװ�ã���ͼ�����ٽ���ʵ�飬B��û�г��ֻ��ǡ������������ΪX�������_____________

A��CO2 B��NH3 C��O3 D��N2 E��NO2
��4��SO2Ϊ������Ⱦ��о�С��Ϊ�ⶨij������������SO2�ĺ�����ȡ10m3(��״��)�Ŀ����� ����ͨ��������ˮ�У���������Һ�м��������BaC12��Һ���������İ�ɫ����ϴ�ӡ�����õ��ӳƳ�������Ϊ0.233g����
�� ����ϴ���Ѿ��ɾ���ʵ�������_________________________________________________��
�� �Լ���˿�����SO2��Ũ��(�г��������ʽ���������������λ��mg/m3��ʾ)��________________________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ���绯ѧԭ�������﹤������ϵĵ�����������ɳ�ȥ����ˮ����NO3-ԭ���ǽ�NO3-��ԭΪN2������˵����ȷ���ǣ�������
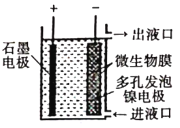
A. �����˵���![]() ��Һ��������Һ�ʼ���
��Һ��������Һ�ʼ���
B. ���缫�ϵĵ缫��ӦʽΪ��![]()
C. ������ʯī�缫����������Һ�������缫
D. ����������![]() ���壬�����Ͽɳ�ȥ
���壬�����Ͽɳ�ȥ![]() mol
mol![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ������������ȷ����
A.1molNH4�����еĵ�����Ϊ11NA
B.0.1L3mol/L��NH4NO3��Һ�е�ԭ��������0.6NA
C.�����£�92gNO2��N2O4�����������ԭ����Ϊ2NA
D.������мȺ������Ӽ����ֺ��й��ۼ������Ȼ����ֻ�������Ӽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ԫ�����ڱ�,����������⡣

��1����Ԫ�����ڱ���ȫ���ǽ���Ԫ�ص�����Ϊ_____________��
a.A b.B c.C d.D
��2��I��IIԪ���γɵĻ�����Ļ�ѧʽΪ_____��һ������____����
��3�����мס������ֶ�����Ԫ��,������,��Ԫ�صĵ��������Ũ���������б��涼���������ܵ�����Ĥ,��Ԫ��ԭ�Ӻ�����������һ���ϵĵ�������ȡ�
�ٽ��ס�����Ԫ�ص�Ԫ�ط�����д������Ԫ�����ڱ��ж�Ӧ��λ��__��д��������NaOH��Һ��Ӧ�����ӷ���ʽ____��
�ڼס�����Ԫ����,�����Խ�ǿ����_____(��Ԫ������),������֤�ý��۵�ʵ����____(�����)��
a.���ڿ����з����Ѿõ�������Ԫ�صĵ��ʷֱ������ˮ��
b.��������Ԫ�صĵ��ʷ�ĩ�ֱ����ͬŨ�ȵ����ᷴӦ
c.��������Ԫ�صĵ��ʷ�ĩ�քe����ˮ����,�������̪��Һ
d.�Ƚ�������Ԫ�ص���̬�⻯����ȶ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2S�����ڶ���ȼ���У��ѳ�ȼ����H2S�ķ����ܶࡣ
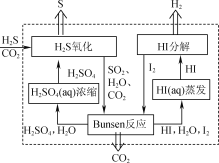
(1) 2019��3�¡�science direct�����ܵĻ�ѧ�������ѳ�H2S��ԭ����ͼ��ʾ��
����H2S��������Ӧ���������뻹ԭ�������ʵ���֮��Ϊ________��
����HI�ֽ���ʱ��ÿ1 mol HI�ֽ����ɵ�����������ʱ������13 kJ��������д���÷�Ӧ���Ȼ�ѧ����ʽ��________��
����Bunsen��Ӧ�������ӷ���ʽΪ________��
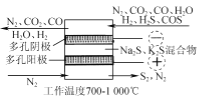
(2) �绯ѧ�ɷ��������ѳ�H2S��ԭ����ͼ��ʾ�����������ĵ缫��ӦΪ________��������COS�����ĵ缫��ӦΪ________��
(3) ��Fe2(SO4)3����Һ�ѳ�H2S�������ķ�Ӧ���£�
(��) H2S(g)![]() H2S(aq)
H2S(aq)
(��) H2S(aq) ![]() H��+HS-
H��+HS-
(��) HS��+2Fe3��=S��+2Fe2��+H��
һ�������²����������Fe3��Ũ�ȵĹ�ϵ��ͼ��ʾ��

������Һ�����˳�S����Һ������������Ͼ��õ�����������________��
��ͼ�е�Fe3����Ũ�ȴ���10 g��L��1ʱ��Ũ��Խ��������Խ�ͣ���������________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijУͬѧ�������ʵ�飬̽��CaS�ѳ������е�SO2������S��ʵ�鲽�����£�
����1.��ȡһ������CaS����������ƿ�в�����״����ܼ�(����ͼ��ʾ)��
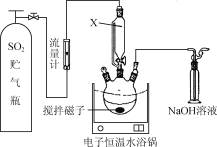
����2.��CaS�ļ״�����Һ�л���ͨ��һ������SO2��
����3.���ˣ�����Һ��������
����4.����Һ�л��ռ״�(�е�Ϊ64.7 ��)�����ò����벽��3�������ϲ���
����5.��CS2����������ȡ���յ���S��
(1) ͼ��������X������ͨ��Һ©����ͻ���ŵ���________________��
(2) ������ƿ���������������ƵĻ�ѧ����ʽΪ________________��������ƿ�������������к�һ������CaSO4����ԭ����________________��
(3) ����4�����ռ״�������еIJ���������________________��
(4) ����5Ϊʹ������S�����ܱ���ȡ���ɲ�ȡ�IJ���������________________��
(5) ����ƴ��������յ�S�͵õ��ĺ�Na2SO3����Һ�Ʊ�Na2S2O3��5H2O��ʵ�鷽����
��ȡ�Թ�����۷����ձ��У�__________________________________________������ֽ���ɡ�
��֪���� ��Һ�����״̬�£��ɷ�����ӦNa2SO3��S��5H2O![]() Na2S2O3��5H2O��
Na2S2O3��5H2O��
��������Na2SO3��Һ�������Ҵ���
��Ϊ��ô�����Ʒ����Ҫ������ɫ������
����ʹ�õ��Լ���S��Na2SO3����Һ���Ҵ�������̿��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������̼����Ԫ����ɵĺϽ�ijʵ��С��Ϊ���о��úϽ�����ʲ��ⶨ�úϽ���̼�������������������ͼʵ�鷽����ʵ��װ�á�(��֪SO2��������KMnO4��Ӧ����������)

I.̽���úϽ��ijЩ���ʣ�
��1��ȡag�Ͻ��ĩ����������ƿ������������ŨH2SO4��A��B�о�����������ԭ����__��
��2����ȼ�ƾ���һ��ʱ���A�о��ҷ�Ӧ����д����ʱ�Ͻ��гɷ�̼����Ļ�ѧ��Ӧ����ʽ__��
��3��װ��D��������__��װ��E��������__��
II.�ⶨ��Ʒ��̼������������
��4��װ��F������__��
��5������Ӧǰ��Eװ�õ������ֱ���m1��m2����Ͻ���̼������������__����û������Dװ�û�ʹ�ⶨ���__������ƫ������ƫС������Ӱ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ���ǣ�������
A. �����£�0.2 mol Fe������ˮ������Ӧ�����ɵ�H2������ĿΪ0.3NA
B. �����£�1 L pH=13��NaOH��Һ�У���ˮ�����OH��������ĿΪ0.1NA
C. ����ȼ�ϵ����������22.4 L����״��������ʱ����·��ͨ���ĵ�����ĿΪ2NA
D. 5NH4NO3![]() 2HNO3+4N2��+9H2O��Ӧ�У�����28 g N2ʱ��ת�Ƶĵ�����ĿΪ3.75NA
2HNO3+4N2��+9H2O��Ӧ�У�����28 g N2ʱ��ת�Ƶĵ�����ĿΪ3.75NA
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com