
【题目】下列有关物质的性质或用途的说法中正确的是
A. 氯气具有漂白性,可以使有色布条褪色
B. 二氧化硫具有较强的还原性,不能用浓硫酸干燥
C. SiO2是酸性氧化物,能与NaOH溶液反应
D. 氧化铁能与酸反应,可用于制作黑色颜料
科目:高中化学 来源: 题型:
【题目】A、B、D、E、G、M六种元素位于元素周期表前四周期,原子序数依次增大。其中,元素A的一种核素无中子,B的单质既有分子晶体又有原子晶体,化合物DE2为红棕色气体,G是前四周期中电负性最小的元素,M的原子核外电子数比G多10。
请回答下列问题:
(1)基态G原子的核外电子排布式是________,M在元素周期表中的位置是_______,元素B、D、E的第一电离能由大到小的顺序为______________(用元素符号表示)。
(2)元素A和E组成的阳离子空间构型为________;化合物ABD的结构式为______,其中B原子的杂化方式为________。
<span style="font-size: 15px; font-family: "宋体";"><span contenteditable="true">(3)</span></span>D的最高价氧化物对应的水化物甲与气体DA3化合生成离子化合物乙,常温下,若甲、乙两溶液的pH均等于5,则由水电离出的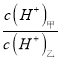 =_________;乙溶液中所含离子的物质的量浓度由大到小的顺序是_______________________________。
=_________;乙溶液中所含离子的物质的量浓度由大到小的顺序是_______________________________。
(4)元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p轨道上有4个电子。
①X与Y所形成化合物中X的化合价等于其族序数,Y达到8电子的稳定结构则该化合物的化学式为______________;
②E的氢化物(H2E)在乙醇中的溶解度大于H2Y,其原因是_________________。
③X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ 键的数目为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将碘水中的碘萃取出来的实验中,下列说法错误的是( )
A.分液漏斗使用前要检查它是否漏水
B.要求萃取剂既不溶于水,且比水更容易使碘溶解
C.分液漏斗注入碘水和萃取剂,反复倒转并用力振荡后,不必静置,应立即分液
D.分液时,下层液体应从下口放出,上层液体应从上口倒出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 甲醇是一种常见的醇,俗称木精或木醇
B. 棉和麻均与淀粉互为同分异构体
C. 19世纪初,德国化学家维勒提出了有机化学概念
D. 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)对于锌—银—稀硫酸组成的原电池装置,当导线中有2mol电子通过时,锌片溶解了______________g ,银片上析出___________升 H2(标准状况下)。
电池总反应的化学方程式为______________。
(2)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如下图所示:

A、B两个电极均由多孔的碳块组成。
该电池的正极反应式为:____________________。若该电池工作时增加了1mol H2O,电路中转移电子的物质的量为_______________。
(3)如果将上述装置中通入的H2改成CH4气体,也可以组成一个原电池装置,则该电池的负极反应式为:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】考古学家可以通过测定古生物化石中14C的含量确定古生物生活的年代.下列关于14C的说法正确的是( )
A.与12C化学性质不同
B.与C60互为同素异形体
C.与12C互为同位素
D.与14N含有的中子数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池是化学对人类的一项重大贡献。
(1)某兴趣小组为研究原电池原理,设计如图A装置。
|
|
A | B |
①a和b不连接时,烧杯中发生反应的离子方程式是 _________________________。
②a和b用导线连接,Cu极为原电池________极(填“正”或“负”),该电极反应式是____________________。
③无论a和b是否连接,Zn片均被腐蚀,若转移了0.2 mol电子, 则理论上Zn片质量减轻________g。
(2)如图是甲烷燃料电池原理示意图B,回答下列问题:
①电池的负极是________(填“a”或“b”)电极,该极的电极反应式为: _________________________。
②电池工作一段时间后电解质溶液的pH__________(填“增大”“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com