
【题目】(1)对于锌—银—稀硫酸组成的原电池装置,当导线中有2mol电子通过时,锌片溶解了______________g ,银片上析出___________升 H2(标准状况下)。
电池总反应的化学方程式为______________。
(2)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如下图所示:

A、B两个电极均由多孔的碳块组成。
该电池的正极反应式为:____________________。若该电池工作时增加了1mol H2O,电路中转移电子的物质的量为_______________。
(3)如果将上述装置中通入的H2改成CH4气体,也可以组成一个原电池装置,则该电池的负极反应式为:____________。
【答案】 65g 22.4L Zn + H2SO4 = ZnSO4 + H2 ↑ O2+2H2O+4e- =4OH- 2mol CH4+10OH-—8e-=CO32-+7H2O
【解析】本题分析:本题主要考查有关原电池的概念判断和计算。
(1)对于锌—银—稀硫酸组成的原电池装置,当导线中有2mol电子通过时,锌呈+2价,锌片溶解了65g ,银片上析出1mol即22.4升 H2(标准状况下)。
电池总反应的化学方程式为Zn + H2SO4 = ZnSO4 + H2 ↑。
(2)该电池的正极通入氧气,正极反应式为:O2+2H2O+4e- =4OH-。若该电池工作时增加了1mol H2O,H2O~2e-,电路中转移电子的物质的量为2mol。
(3)如果将上述装置中通入的H2改成CH4气体,则该电池的负极反应式为:CH4+10OH-—8e-=CO32-+7H2O。


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】25 ℃时,几种弱酸的电离常数如下:
弱酸化学式 | HNO2 | CH3COOH | HCN | H2CO3 |
电离常数 | 5.1×10-4 | 1.8×10-5 | 6.2×10-10 | K1=4.4×10-7 K2=4.7×10-11 |
(1)根据上表数据填空:
①物质的量浓度相同的四种酸,其pH由大到小的顺序是___________ (用化学式填写)。
②分别向等体积、相同pH的HCl溶液和CH3COOH溶液中加入足量的Zn粉,反应刚开始时产生H2的速率:v(HCl)______v(CH3COOH)(填“=”、“>”或“<”下同),反应完全后,所得氢气的质量:m(H2)盐酸_______m(H2)醋酸。
③将0.2 mol/L HCN溶液与0.1 mol/L Na2CO3溶液等体积混合,发生反应的化学方程式为___________________________。
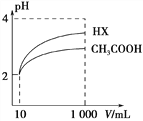
(2)体积均为10 mL、pH均为2的醋酸溶液与一元酸HX分别加水稀释至1000 mL,稀释过程中溶液pH变化如图所示。稀释后,HX溶液中水电离的c(H+)___醋酸溶液中水电离的c(H+) ;电离常数Ka(HX)___Ka(CH3COOH)(填“>”、“=”或“<”)。
(3)CO32- 、 NO2- 、CN-、CH3COO-结合H+的能力由强到弱的顺序为_______________________(用离子符号表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种原子序数依次增大的分别位于三个不同短周期的主族元素,m、n、p分别是元素A、B、C、的单质, x、y、z是由A、B、C组成的二元化合物,其中y、z是气体且y可用于配制饮料,它们之间有如下转化关系,D的单质可与热水发生置换反应,下列说法正确的是( )

A. D的单质起火燃烧时可用y作灭火剂
B. 元素的非金属性:C>A>B>D
C. B、C、D与A形成的简单化合物的熔点:C>D>B
D. 原子半径:D>B>C>A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2016天津)下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题
(1)Z元素在周期表中的位置为__________。
(2)表中元素原子半径最大的是(写元素符号)__________。
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是__________。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1 mol Y单质比1 mol S得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)X与Z两元素的单质反应生成1 mol X的最高价化合物,恢复至室温,放热687 kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式:__________。
(5)碳与镁形成的1mol化合物Q与水反应,生成2 mol Mg(OH)2和1 mol烃,该烃分子中碳氢质量比为9∶1,烃的电子式为__________。Q与水反应的化学方程式为__________。
(6)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由上表中两种元素组成,气体的相对分子质量都小于50。为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1 L2.2 mol/L NaOH溶液和1 mol O2,则两种气体的分子式及物质的量分别为__________,生成硫酸铜物质的量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质或用途的说法中正确的是
A. 氯气具有漂白性,可以使有色布条褪色
B. 二氧化硫具有较强的还原性,不能用浓硫酸干燥
C. SiO2是酸性氧化物,能与NaOH溶液反应
D. 氧化铁能与酸反应,可用于制作黑色颜料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与实验相关的叙述不正确的是
A. 蒸发完成时,用坩埚钳把蒸发皿移至实验桌上冷却
B. 乙酸乙酯的制备中,长导管不能伸到饱和碳酸钠溶液中
C. 分液操作时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出
D. 配制一定物质的量浓度的溶液,定容时仰视刻度,溶液浓度偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2C2O4为二元弱酸。20℃时,配制一组c(H2C2O4)+ c(HC2O4–)+ c(C2O42–)=0.100 mol·L–1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是

A.pH=2.5的溶液中:c(H2C2O4)+c(C2O42–)>c(HC2O4–)
B.c(Na+)=0.100 mol·L–1的溶液中:c(H+)+c(H2C2O4)=c(OH–)+c(C2O42–)
C.c(HC2O4–)=c(C2O42–)的溶液中:c(Na+)>0.100 mol·L–1+c(HC2O4–)
D.pH=7的溶液中:c(Na+)>2c(C2O42–)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某反应A(g)+B(g)![]() C(g)+D(g),过程中的能量变化如图所示,回答下列问题。
C(g)+D(g),过程中的能量变化如图所示,回答下列问题。

(1)该反应是________反应(填“吸热”或“放热”),该反应的ΔH=________ kJ·mol-1(用含E1,E2的代数式表示),1 mol气体A和1 mol气体B具有的总能量比1 mol气体C和1 mol气体D具有的总能量________(填“一定高”“一定低”或“高低不一定”)。
(2)若在反应体系中加入催化剂使逆反应速率增大,则E1和E2的变化是:E1________,E2________,ΔH________(填“增大”“减小”或“不变”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com