
| A、质子数相同,中子数不同的核素互称为同位素 |
| B、氘(D)原子核外有1个电子 |
| C、H2O与D2O互称同素异形体 |
| D、1H218O与D216O的相对分子质量相同 |


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、P(NH3)>P(H2)>P(O2) |
| B、P(O2)>P(NH3)>P(H2) |
| C、P(H2)>P(O2)>P(NH3) |
| D、P(H2)>P(NH3)>P(O2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在标准状况下,2.24L CCl4中含有C-Cl键的数目为0.4NA |
| B、0.2molPCl5分子中,σ键数目为NA |
| C、28g聚乙烯分子中含有的碳原子数为2NA |
| D、0.1mol椅式环已烷所含C-C数目为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、气体的摩尔体积约为22.4L?mol-1 |
| B、1 mol H2的质量是2g,它所占的体积约是22.4L?mol-1 |
| C、在标准状况下,1 mol任何物质所占的体积都约为22.4L?mol-1 |
| D、在标准状况下,1 mol任何气体所占的体积都约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、雷雨天:N2+O2═2NO |
| B、工业上合成氨:N2+3H2?2NH3 |
| C、大豆根瘤菌将N2转化成化合态氮 |
| D、2NO+O2═2NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 装置如图:D是盐桥,E是稳压电源,R是可变电阻,K是开关,G是灵敏电流计,C1、C2是碳棒,A、B是烧杯.
装置如图:D是盐桥,E是稳压电源,R是可变电阻,K是开关,G是灵敏电流计,C1、C2是碳棒,A、B是烧杯.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
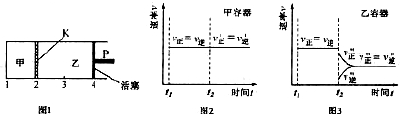
| A、保持温度和活塞位置不变,在甲中再加入 1molA 和 2molB,达到新的平衡后,甲中压强是乙中压强的2倍 |
| B、保持温度和活塞位置不变,t2 时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1 前的反应速率变化已省略) |
| C、保持温度不变,移动活塞 P,使乙的容积和甲相等,达到新的平衡后,乙中 C 的体积分数是甲中C的体积分数的 2 倍 |
| D、保持温度不变,移动活塞 P,使乙的容积和甲相等,达到新的平衡后,乙中气体密度比甲中气体密度的 2 倍小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com