
����Ŀ�����ᡢ�������������ѧ�γ������������������־������������ͭ��Ӧ��������ش��������⣺
��1��ϡ�����Cu ��Ӧ������ϡ�����м���H2O2�����ʹͭ˳���ܽ⡣�÷�Ӧ�Ļ�ѧ����ʽΪ��___________________��
��2����һ�������10mol/L��Ũ�����м������ͭƬ������ʹ֮��Ӧ������ԭ������Ϊ0.9mol����Ũ�����ʵ�����__________(�������������� ����������С����)180mL����ʹʣ���ͭƬ�����ܽ⣬�������м�����������Һ(��KNO3��Һ)����÷�Ӧ�����ӷ���ʽΪ________________��
��3��þ�������4.9g���ܽ��ڹ�����ijŨ�ȵ�ϡ�����У���ȫ��Ӧ��õ���״����2 .24LNO���塣����Ӧ�����Һ�м����������ռ������ɳ�����������____________��
���𰸡���1��H2O2+Cu+2HCl = CuCl2+2H2O��
��2��������3Cu+8H++2NO3- = 3Cu2++2NO��+4H2O��
��3��10g��
��������
�����������1���������������Ի������ܹ�����ͭ����ͭ��������ѧ����ʽ��Cu+H2O2+2HCl = CuCl2+2H2O���ʴ�Ϊ��Cu+H2O2+2HCl = CuCl2+2H2O��
��2��ֻͭ�ܺ�Ũ���ᷴӦ��ϡ�����Ӧ��Cu+2H2SO4(Ũ)![]() CuSO4+SO2��+H2O������ͭ��Ũ����ķ�Ӧ�Ľ��������Ũ��Խ��ԽС�����ٲ�������������������ԭ��������0.9mol����10molL-1��Ũ�����ʵ�����Ҫ����180mL����ʹʣ���ͭƬ�����ܽ����������м�����������ӦΪ��Һ����H+���ټ�������������NO3-���൱�ڴ����������������ܽ�ͬ�ܽ�����Ӧʵ��Ϊ��3Cu+8H++2NO3- = 3Cu2++2NO��+4H2O���ʴ�Ϊ��������3Cu+8H++2NO3- = 3Cu2++2NO��+4H2O��
CuSO4+SO2��+H2O������ͭ��Ũ����ķ�Ӧ�Ľ��������Ũ��Խ��ԽС�����ٲ�������������������ԭ��������0.9mol����10molL-1��Ũ�����ʵ�����Ҫ����180mL����ʹʣ���ͭƬ�����ܽ����������м�����������ӦΪ��Һ����H+���ټ�������������NO3-���൱�ڴ����������������ܽ�ͬ�ܽ�����Ӧʵ��Ϊ��3Cu+8H++2NO3- = 3Cu2++2NO��+4H2O���ʴ�Ϊ��������3Cu+8H++2NO3- = 3Cu2++2NO��+4H2O��
��3��n(NO) = 0.1mol������0.01mol NO��ת�Ƶĵ��ӵ����ʵ���Ϊ��n(e-) = 0.1mol��(5-2) = 0.3mol����Ӧ�д�����Mg��Mg2+��Mg(OH)2��Fe��Fe3+��Fe(OH)3���ó�n(e-) = n(OH-)����m(����) = m(�����)+m(OH-)������m(����) = 4.9g+0.3mol��17g/mol = 10g���ʴ�Ϊ��10g��


 A�ӽ��� ϵ�д�
A�ӽ��� ϵ�д� ȫ�Ų��Ծ�ϵ�д�
ȫ�Ų��Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ҫ�ɷֿɱ�ʾΪFeO��Cr2O3��������MgO��Al2O3��Fe2O3�����ʣ��Ը�����Ϊԭ���Ʊ��ظ����(K2Cr2O7���Ĺ�������(���ֲ���������������
��.���������̼���ƻ�ϳ�ֱ��ա�
��.���պ�Ĺ����ˮ��ȡ������õ���ҺA����A��
��.����ҺA�м�������pHԼ7��8������õ���ҺB����B��
��.������ҺB�м����Ӵ����ữ��ʹ��ҺpHС��5��
��.��������Һ�м����Ȼ��أ��õ��ظ���ؾ��塣
���б��շ����ķ�Ӧ���£���ƽ����д��ȱ��
FeOCr2O3 + Na2CO3 + = Na2CrO4 + Fe2O3 + CO2����
��Na2CO3+Al2O3=2NaAlO2+CO2����
��2������A����Ҫ���� (��д��ѧʽ����
��3����֪�ظ������Һ�д�������ƽ�⣺2CrO42����2H+![]() Cr2O72����H2O�����е�����ҺpH��5ʱ����Ŀ���� ��
Cr2O72����H2O�����е�����ҺpH��5ʱ����Ŀ���� ��
��4�����з�����Ӧ�Ļ�ѧ����ʽ�ǣ�Na2Cr2O7+2KCl=K2Cr2O7��+2NaCl����֪�±�����
���� | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
�ܽ�� (g/100gˮ�� | 0 | 28 | 35.7 | 4.7 | 163 |
40 | 40.1 | 36.4 | 26.3 | 215 | |
80 | 51.3 | 38 | 73 | 376 | |
���÷�Ӧ�ܷ����������� ��
�����K2Cr2O7����IJ����жಽ��ɣ������ǣ�����KCl���塢____________��____________�����ˡ�ϴ�ӡ�����õ����塣
��5�����й���B����Ҫ��������������������þ���������ܻ����P���������ʣ���ȷ��������B���������������ķ����ǣ���ȡn g��Ʒ���������____________(��д�Լ����������ܽ⡢���ˡ���ͨ�������CO2�������ա���ȴ���������ø������m g��������Ʒ��������������������Ϊ____________(�ú�m��n�Ĵ���ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����amolFeCl2����Һ�м��뺬bmolBr2����ˮ����ַ�Ӧ������˵������ȷ����
A�����ӵĻ�ԭ��ǿ����I- >Fe2+ >Br-
B����a��bʱ�����������ӷ�Ӧ��2I-+ Br2= I2+2Br-
C����3a��2bʱ�����������ӷ�Ӧ��2Fe2++2I-+2Br2=2Fe3++I2+4Br-
D����5a=4bʱ����Ӧ�������Ũ��֮�ȣ�c(Fe2+����c(Fe3+����c(Br-��=1:1:5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͬѧ�ǿ���̽��������ʻ�н�����8��ʵ���Ϊ�������������ͼ��ʾ����
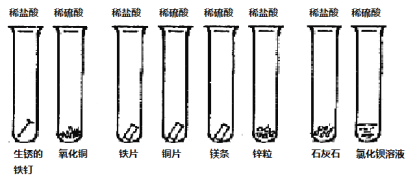
�� �� �� �� �� �� �� ��
��1����8��ʵ������η���ģ���д��������Թܱ�ţ���һ�� �ڶ��� ������ ������Ϊ��˷���������ǣ� ��
��2��д���Թ��ڢ���ʵ�������йص����ӷ���ʽ��
�� �� ��
�� �� ��
��3������Ϊ����С���Ա������ʵ�鼰����ķ������Ƚϣ����ɳ��Ľ��������ٴ�3������
��___________________________________��
��___________________________________��
��____________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�� ��֪NAΪ�����ӵ�������ֵ���йز���(HOOC-COOH)������˵���д������( )
A��9.0g�����й��õ��Ӷ���ĿΪ0.9NA
B��9.0 g���ᱻNaClO��������CO2��ת�Ƶĵ�����Ϊ0.2 NA
C��9.0 g��������ˮ������C2O42-��HC2O4-������֮��Ϊ0.1NA
D��9.0g����������ȫ�ֽ�ΪCO2��CO��H2O������²�����ɵ��������Ϊ4.48 L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NAΪ����٤��������ֵ������˵����ȷ����
A. 100g��������Ϊ46%���Ҵ�ˮ��Һ����ԭ����ĿΪ12NA
B. 1L0.5mol/L��CH3COOH��Һ�к��е�H+��Ϊ0.5NA
C. ��״���£�0.2NA��SO3������ռ�е����ԼΪ4.48L
D. ����1molCl2���뷴Ӧʱ������ת����ĿΪ2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�ʵ�������+7����6����4���̵Ļ����ﶼ�ܺ�Ũ���ᷴӦ�Ƶ������һ�ԭ���ﶼ��MnCl2����6.32gKMnO4��ĩ����һ��ʱ����ռ���0.112L����(��״������ͬ)����ȴ�����������Ũ�����ټ��ȣ����ռ���VL����ɫ���壬������ȷ����( )
A��V=2.24L
B���μӷ�Ӧ��HClΪ0.18mol
C����ȷ���������ɺ��ػ�����������Ƕ���
D��6.32g KMnO4��ĩ��ֱ��������Ũ���ᷴӦ�ɵõ�2.24L Cl2(��״��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ�Ϊ2 L��3���ܱ������з�����Ӧ3A(g)��B(g)![]() xC(g)������ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱ�й��������£�
xC(g)������ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱ�й��������£�
���� | �� | �� | �� |
��Ӧ��Ͷ���� | 3 mol A��2 mol B | 6 mol A��4 mol B | 2 mol C |
����ƽ���ʱ�䣨min�� | 5 | 8 | |
A��Ũ�ȣ�mol/L�� | c1 | c2 | |
C��������� | w1 | w3 | |
��������ܶȣ�g/L�� | ��1 | ��2 |
����˵����ȷ������ ��
A����x<4����2c1<c2
B����w3��w1���ɶ϶�x��4
C������x��ֵ�Ƕ��٣�����2��1����2
D���������з�Ӧ�ӿ�ʼ����ƽ��ƽ������Ϊv(A)��0.3 mol��L��1��min��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������ԭ����Ŀ��ȵ���
A��34gH2O2��18gH2O B��2gO3��2gO2
C��5gCO��10gN2 D��1gH2��8gO2
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com