
【题目】向含Al2(SO4)3和AlCl3的混合溶液中逐滴加入1mol/LBa(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的物质的量的关系如图。

(1)写出OA段离子反应方程式_______________。
(2)写出BC段离子反应方程式_______________。
(3)c[Al2(SO4)3]:c(AlCl3)=___________。
(4)整个过程中,得到沉淀的质量最大值是_______g。
【答案】 3Ba2++2Al3++6OH-+3SO42-=3BaSO4↓+2Al(OH)3↓ Al(OH)3+OH-═AlO2-+2H2O 1:2 1011
【解析】向含Al2(SO4)3 和 AlCl3的混合溶液与Ba(OH)2溶液反应的实质是Al3+与OH-、Ba2+与SO42-之间的离子反应,Ba2++SO42-═BaSO4↓,Al3++3OH-═Al(OH)3↓,Al(OH)3+OH-═AlO2-+2H2O,1molAl2(SO4)3中SO42-完全被沉淀所需Ba(OH)2量为3mol,3molBa(OH)2提供6molOH-,1molAl2(SO4)3中含有2molAl3+,由反应Al3++3OH-═Al(OH)3↓可知,1molAl2(SO4)3中的Al3+和SO42- 均沉淀完全,故:从起点到A点,可以认为是硫酸铝与氢氧化钡恰好发生反应生成3molBaSO4、2molAl(OH)3沉淀,A点时SO42-完全沉淀;A-B为氯化铝与氢氧化钡的反应,B点时溶液中Al3+完全沉淀,产生沉淀达最大值,溶液中溶质为BaCl2;B-C为氢氧化铝与氢氧化钡反应,C点时氢氧化铝完全溶解。
(1)根据上述分析,OA段相当于Al2(SO4)3中的Al3+和SO42- 均沉淀完全,反应的离子反应方程式为3Ba2++2Al3++6OH-+3SO42-=3BaSO4↓+2Al(OH)3↓,故答案为:3Ba2++2Al3++6OH- +3SO42-=3BaSO4↓+2Al(OH)3↓;
(2)BC段为氢氧化铝与氢氧化钡反应,离子反应方程式为Al(OH)3+OH-═AlO2-+2H2O,故答案为:Al(OH)3+OH-═AlO2-+2H2O;
(3)前3LBa(OH)2溶液与溶液中Al2(SO4)3反应,从3L-6L为Ba(OH)2溶液与溶液中的AlCl3反应,二者消耗的氢氧化钡的物质的量相等为3L×1mol/L=3mol,由生成的硫酸钡可知,n(SO42-)=n[Ba(OH)2]=3n[Al2(SO4)3],故n[Al2(SO4)3]=1mol,由氯化铝与氢氧化钡生成氢氧化铝可知3n(AlCl3)=2n[Ba(OH)2]=6mol,故n(AlCl3)=2mol,故原溶液中原混合液中c[Al2(SO4)3]:c(AlCl3)=1:2,故答案为:1:2;
(4)整个过程中,得到沉淀的质量最大时,沉淀中含有3mol硫酸钡和4mol氢氧化铝,质量为3mol×233g/mol+4mol×78g/mol=1011g,故答案为:1011。


科目:高中化学 来源: 题型:
【题目】关于如图所示各装置图的叙述不正确的是( ) 
A.用装置①精炼铜,a极为粗铜,电解质溶液为硫酸铜溶液
B.装置②盐桥中KCl的Cl﹣ 移向乙烧杯
C.装置③中钢闸门应与外接电源的负极相连
D.装置④可以验证温度对化学平衡的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W有如图所示的转化关系(反应条件和部分其它反应物省略),则X、Y、Z可能是( )

①Na、Na2O、Na2O2 ②AlCl3、Al(OH)3、NaAlO2 ③Fe、FeCl2、FeCl3 ④NaOH、Na2CO3、NaHCO3 ⑤C、CO、CO2
A. ①②③④⑤ B. ②④ C. ①③⑤ D. ①②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氯化氢和盐酸的叙述中,正确的是( )
A. 它们都用 HCl 表示,两者没有区别
B. 氯化氢和盐酸在潮湿的空气中都形成酸雾
C. 氯化氢和盐酸都能导电
D. 氯化氢是无色气体,盐酸是无色溶液,它们都有刺激性气味
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是 ( )
A. 1 mol SO2的质量为64 g·mol-1B. Mg2+的摩尔质量是24 g
C. CO的摩尔质量是28 g·mol-1D. 氮的摩尔质量是28 g·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用Fe2O3与CO反应来制取单质Fe。
(1)请按气流由左到右的方向连接下列各装置,顺序为A→____→____ →____ →____ 。___________
(2)检查装置A气密性的方法是____________________。
(3)在点燃B处的酒精灯前,应进行的操作是_______。
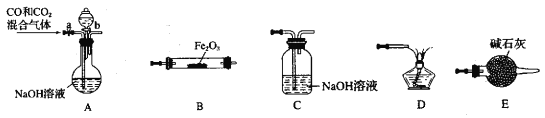
(4)若用100mL0.1molL的NaOH 溶液吸收224mLCO2气体(标准状况),恰好完全吸收。再将所得溶液加入100mL0.1mol/L氢氧化钙溶液中。请写出所得溶液与氢氧化钙溶液反应的离子方程式:________________。
(5)配制100mL 0.1mol/LNaOH 溶液时,下列操作会导致所配溶液浓度偏高的操作是______。A.容量瓶用蒸馏水洗涤后未进行干燥处理,底部有少量水残留。
B.用蒸馏水溶解氢氧化钠固体后,立即转移到容量瓶中,然后洗涤、定容。
C.定容摇匀后,发现液面低于刻度线,又加水到刻度线位置
D.定容时仰视刻度线
E.称量氢氧化钠固体时所用砝码生锈
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com