
【题目】Ⅰ下列单元操作中采用了热交换设计的有
A.电解食盐水制烧碱 |
B.合成氨中的催化合成 |
C.硫酸生产中的催化氧化 |
D.氨碱法中的氨盐水碳酸化 |
Ⅱ海水晒盐的卤水中还有氯化镁,以卤水为原料生产镁的一中工艺流程如下图所示。
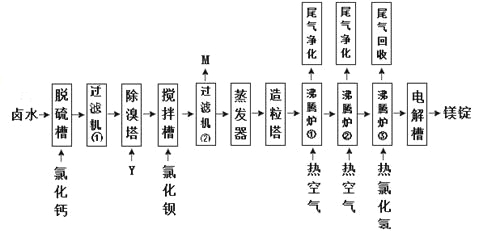
回答下列问题:
(1)脱硫槽、搅拌槽均用于脱除卤水中的(填离子符号),M的主要成分是(填化学式)。
(2)除溴塔中主要的离子方程式为。
(3)沸腾炉①和②的主要作用是。沸腾炉③通入热氯化氢的主要目的是。
(4)电解槽中阴极的电极反应方程式为。
(5)电解槽中阳极产物为,该产物可直接用于本工艺流程中的。
【答案】Ⅰ BC
Ⅱ(1)SO42-BaSO4(每空1分,共2分)
(2)Cl2+2Br-==2Cl-+Br2(2分)
(3)脱除氯化镁晶体中的部分水防止氯化镁晶体进一步脱水过程中发生水解(每空2分,共4分)
(4)Mg2++2e-==Mg (2分)
(5)氯气;除溴塔(除溴工段)(每空2分,共4分)
【解析】试题分析:20-I.合成氨工业和硫酸工业中都有放热的可逆反应过程,故需采用热交换设计充分利用废热。而电解食盐水制烧碱及氨碱法中的氨盐水碳酸化是水溶液中的反应,不需要热交换,故选BC。
20-II.海水晒盐的卤水中除MgCl2之外,含有KCl、KBr和MgSO4等物质。根据流程,需要将Br-和SO42-除去。然后将溶液干燥得晶体,过程中需注意防止氯化镁晶体的水解。再通过电解法得镁。
(1)根据原理分析,可知脱硫槽、搅拌槽均用于脱除卤水中的SO42-,X除去的为BaSO4,M除去的为主要成分是BaSO4。
(2)除溴塔中是利用氯气将Br-氧化为Br2,离子方程式为Cl2+2Br-==2Cl-+Br2。
(3)沸腾炉①和②的主要作用是脱除氯化镁晶体中的部分水。沸腾炉③通入热氯化氢的主要目的是防止氯化镁晶体进一步脱水过程中发生水解。
(4)电解槽中为电解熔融的MgCl2,故阴极的电极反应方程式为Mg2++2e-==Mg。
(5)电解槽中阳极产物为Cl2,可直接用于本工艺流程中的除溴阶段。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】高温下,某反应达平衡,平衡常数K=![]() 。恒容时,温度升高,H2浓度减小。下列说法正确的是
。恒容时,温度升高,H2浓度减小。下列说法正确的是
A、该反应的焓变为正值
B、恒温恒容下,增大压强,H2浓度一定减小
C、升高温度,逆反应速率减小
D、该反应化学方程式为CO+H2O=CO2+H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资源的高效利用对保护环境、促进经济持续健康发展具有重要作用。磷尾矿主要含Ca5(PO4)3F和CaCO3·MgCO3。某研究小组提出了磷尾矿综合利用的研究方案,制备具有重要工业用途的CaCO3、Mg(OH)2、P4和H2,其简化流程如下:

已知:①Ca5(PO4)3F在950℃不分解;
②4Ca5(PO4)3F+18SiO2+30C![]() 2CaF2+30CO+18CaSiO3+3P4
2CaF2+30CO+18CaSiO3+3P4
请回答下列问题:
(1)950℃煅烧磷尾矿生成气体的主要成分是___________。
(2)实验室过滤所需的玻璃仪器是_____________。
(3)NH4NO3溶液能从磷矿Ⅰ中浸取出Ca2+的原因是__________。
(4)在浸取液Ⅱ中通入NH3,发生反应的化学方程式是____________。
(5)工业上常用磷精矿[Ca5(PO4)3F]和硫酸反应制备磷酸。已知25℃,101kPa时:
CaO(s)+H2SO4(l)=CaSO4(s)+H2O(l) ΔH=-271kJ/mol
5 CaO(s)+3H3PO4(l)+HF(g)= Ca5(PO4)3F (s)+5H2O(l) ΔH=-937kJ/mol
则Ca5(PO4)3F和硫酸反应生成磷酸的热化学方程式是_________________。
(6)在一定条件下CO(g)+H2O(g)![]() CO2(g)+H2(g),当CO与H2O(g)的起始物质的量之比为1:5,达平衡时,CO转化了
CO2(g)+H2(g),当CO与H2O(g)的起始物质的量之比为1:5,达平衡时,CO转化了![]() 。若a kg含Ca5(PO4)3F(相对分子质量为504)的质量分数为10%的磷尾矿,在上述过程中有b%的Ca5(PO4)3F转化为P4,将产生的CO与H2O(g)按起始物质的量之比1:3混合,则相同条件下达平衡时能产生H2________kg。
。若a kg含Ca5(PO4)3F(相对分子质量为504)的质量分数为10%的磷尾矿,在上述过程中有b%的Ca5(PO4)3F转化为P4,将产生的CO与H2O(g)按起始物质的量之比1:3混合,则相同条件下达平衡时能产生H2________kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同。
(1)第四周期过渡元素的明显特征是形成多种多样的配合物
① CO可以和很多过渡金属形成配合物,如羰基铁[Fe(CO)5].羰基镍[Ni(CO)4]。CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,CO的结构式为 ,与CO互为等电子体的离子为 (填化学式)。
② 金属镍粉在CO气流中轻微加热,生成液态Ni(CO)4分子。423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉。试推测Ni(CO)4易溶于下列 。
A.水 B.四氯化碳 C.苯 D.硫酸镍溶液
(2)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的。镓的基态原子的电子排布式是 ,Ga的第一电离能却明显低于Zn,原因是 。
(3)用价层电子对互斥理论预测H2Se和BBr3的立体结构,两个结论都正确的是 。
A.直线形;三角锥形
B.V形;三角锥形
C.直线形;平面三角形
D.V形;平面三角形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。已知:
CH3OH(g)+3/2O2(g)===CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
CO(g)+1/2O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
H2(g)+1/2O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
则CO(g)+2H2(g) ![]() CH3OH(g) ΔH=______kJ·mol-1。
CH3OH(g) ΔH=______kJ·mol-1。
(2)下列措施中能够增大上述合成甲醇反应速率的是________(填写序号)。
a.使用高效催化剂 b.降低反应温度
c.增大体系压强 d.不断将CH3OH从反应混合物中分离出来
(3)在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系
如右图所示。
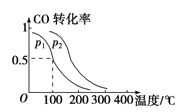
①p1________p2(填“大于”、“小于”或“等于”);
②100 ℃时,该反应的化学平衡常数K=________;
③在其他条件不变的情况下,再增加a mol CO和2a mol H2,达到新平衡时,CO的转化率________(填“增大”、“减小”或“不变”)。
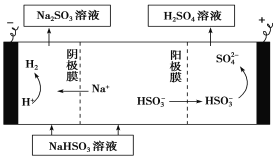
(4)某科研小组用SO2为原料制取硫酸。
①利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。请写出该电池负极的电极反应式:_____________________。
②用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解原理示意图如下。请写出开始时阳极反应的电极反应式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
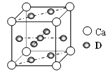
【题目】A、B、C都是元素周期表中的短周期元素,它们的核电荷数依次增大。第2周期元素A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半满结构,C是地壳中含量最多的元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请用对应的元素符号或化学式填空:
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)A的最高价氧化物对应的水化物分子中其中心原子采取 杂化。
(3)与A、B形成的阴离子(AB-)互为等电子体的分子有 。
(4)基态D原子的核外电子排布式为 ,右图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比为 。
(5)向D的高价态硫酸盐溶液中逐滴滴加B的氢化物水溶液至过量,先出现蓝色沉淀,最后溶解形成深蓝色的溶液。写出此蓝色沉淀溶解的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】兰尼镍是一种带有多孔结构的细小晶粒组成的镍铝合金,被广泛用作有机物的氢化反应的催化剂。以红土镍矿(主要成分为NiS、FeS和SiO2等)为原料制备兰尼镍的工艺流程如下图所示:

(1)在形成Ni(CO)4的过程中,碳元素的化合价没有变化,则Ni(CO)4中的Ni的化合价为___________;
(2)已知红土镍矿煅烧后生成Ni2O3,而加压酸浸后浸出液A中含有Ni2+,写出有关镍元素的加压酸浸的化学反应方程式______________________;
(3)向浸出液A中通入H2S气体,反应的离子方程式是____________________;
(4)“高温熔融”时能否将通入氩气换为CO并说明原因_____________________;
(5)“碱浸”的目的是使镍铝合金产生多孔结构,从而增强对氢气的强吸附性,此过程
中发生反应的离子方程式为___________________。浸出反应所用的NaOH溶液的浓度要大,若NaOH溶液较稀时,则会产生少量的Al(OH)3沉淀而阻止浸出反应的持续进行,请用化学反应原理加以解释:________________________。
(6)浸出液B可以回收,重新生成铝以便循环利用。请设计简单的回收流程:
浸出液B→________________________。(示例:CuOCu2+Cu)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知酸性KMnO4溶液可氧化C2H4生成CO2气体。则下列可用来鉴别CH4和C2H4,又可除去CH4中混有C2H4的方法是( )
A. 通入H2后加热
B. 通入酸性KMnO4溶液中
C. 通入足量的溴水中
D. 点燃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是自然界存在最广泛的ⅡA族元素,常以化合物F存在。从单质A起始发生的一系列化学反应可由下图表示:
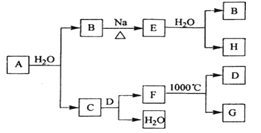
请回答下列问题:
(1)A与水反应的化学方程式为_____________,E与水反应的化学方程式为___________;
(2)F的化学式为___________,G和D的电子式分别为_____________和____________;
(3)D与H反应可能生成的盐有_____________ (填化学式);
(4)实际生产中,可由F为原料制备单质A,简述一种制备方法_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com