
【题目】阿文同学想测定某Cu-Ag合金中两种金属的质量比。称取这种合金9.6g,加入足量AgNO3溶液充分反应后过滤,将所得固体洗涤、干燥后称量,质量为24.8g。
(1)发生反应的化学方程式为______________________。
(2)试计算该合金中铜与银的质量比__________。
【答案】2AgNO3 + Cu === Cu(NO3)2 + 2Ag2:1
【解析】
(1)铜的活泼性大于银,铜能够与硝酸银溶液反应置换出银。
(2)根据质量守恒定律可知,根据剩余的固体应为原固体混合物中的银以及反应生成银的质量总和进行解答。
(1)铜的活泼性大于银,因此Cu-Ag合金加入足量AgNO3溶液充分反应,铜能够置换出银,反应的化学方程式为:2AgNO3 + Cu === Cu(NO3)2 + 2Ag;正确答案:2AgNO3 + Cu === Cu(NO3)2 + 2Ag。
(2)设9.6gCu-Ag合金中Cu的质量为x,则Cu-Ag合金中Ag的质量为9.6g-x,反应生成的Ag的质量为24.8g-(9.6g-x)=15.2g+x,然后根据方程式进行计算:

64/x=216/(15.2+x),解得:x=6.4g;m(Ag)=9.6g-6.4g=3.2g;m(Cu):m(Ag)=6.4g:3.2g=2:1;正确答案:2:1。


科目:高中化学 来源: 题型:
【题目】废旧金属可以回收利用,用合金废料(含铁、铜和铝)制取硫酸亚铁和硫酸铜溶液的实验流程如下(部分生成物已略):

(1)合金属于________(填“纯净物”或“混合物”)。
(2)步骤①反应的化学方程式为:2Al+2NaOH+2R=2NaAlO2+3H2↑,依据质量守恒定律推出R的化学式为_________。步骤②反应的化学方程式为_____________________________。
(3)由铜制取硫酸铜溶液有以下三种途径:
I.Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
II.2Cu+O2![]() 2CuO CuO+H2SO4=CuSO4+H2O
2CuO CuO+H2SO4=CuSO4+H2O
Ⅲ.3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
你认为最佳途径是____________(填序号),理由是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学就在我们身边,它与我们的生活息息相关。
(1)现有H、C、Na、O、Ca六种元素,请选用其中的元素书写下列化学用语:
①可做食品干燥剂的氧化物__________ ;
②厨房中常用的酸__________________ ;
③侯氏制碱法制得的“碱”____________ ;
④含氧量最高的氧化物______________ 。
(2)铅蓄电池在生产、生活中使用广泛.其构造示意图如图,回答下列问题:
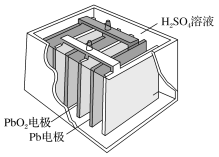
①铅蓄电池充电时是将电能转化为__________ 能。
②铅蓄电池放电过程中,反应的化学方程式为 Pb+PbO2+2H2SO4===2PbSO4+2H2O,据此可知,铅蓄电池在放电时,溶液的pH不断__________ (填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于苯的结构和性质叙述中,不正确的是( )
A.苯能使酸性高锰酸钾溶液褪色
B.苯燃烧时能产生大量黑烟
C.苯难溶于水
D.常温下,苯不能与溴水发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中有相邻元素A、B、C,A与B同周期,B与C同主族,它们的原子最外层电子数之和为19,原子序数之和为41,则这三种元素的名称分别为:
A________,B________,C________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年科学家提出“绿色自由”构想。把含有大量CO2的空气吹入K2CO3溶液中,再把CO2从溶液中提取出来,并使之与H2反应生成可再生能源甲醇。其工艺流程如下图所示:

回答下列问题:
(1)进入分解池中主要物质是______;在合成塔中,若有4.4kgCO2与足量H2反应,生成气态的H2O和CH3OH,可放出5370kJ的热量,写出该反应的热化学方程式:____________。
(2)该工艺在哪些方面体现了“绿色自由”构想中的“绿色”:①____________;②________。
(3)一定条件下,往2L恒容密闭容器中充入1.0molCO2和3.0 mol H2,在不同催化剂作用下,相同时间内CO2的转化率随温度变化如下图所示:

①催化剂效果最佳的是_______(填“催化剂I”.“催化剂Ⅱ”,“催化剂Ⅲ”)。b点v(正)______v(逆)(填“>”,“<”,“=”)。
②此反应在a点时已达平衡状态,a点的转化率比c点高的原因是___________。c点时该反应的平衡常数K=___________。
(4)科学家还研究了其它转化温室气体的方法,利用下图所示装置可以将CO2转化为气体燃料CO。该装置工作时的总反应方程式为_________________。

(5)己知25℃时H2CO3的电离平衡常数为:Kal=4.4×10-7、Ka2=4.7×l0-ll,则反应:HCO3- +H2O![]() H2CO3+ OH-的平衡常数K=________。
H2CO3+ OH-的平衡常数K=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 反应N2(g)+3H2(g)![]() 2NH3(g)的ΔS>0
2NH3(g)的ΔS>0
B. 地下钢铁管道用导线连接铜块可以减缓管道的腐蚀
C. 常温下Ksp[Mg(OH)2]=5.6×10-12,含Mg2+溶液中pH=10 时c(Mg2+)≤5.6×10-4 mol·L-1
D. 常温常压下,锌与稀H2SO4反应生成11.2 LH2,反应中转移的电子数为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某溶液中Cl-、Br-、I-的物质的量之比为2:3:4,要使溶液中的Cl-、Br-、I-的物质的量之比变为4:3:2,则通入Cl2的物质的量与原溶液中I-的物质的量之比为________。
(2)要使溶液中只有Cl-和Br-,而没有I-,则此时Cl-和Br-的物质的量之比为________。
(3)若要使溶液中只有Cl-,则通入Cl2的物质的量和原溶液中Br-的物质的量之比为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com