
【题目】下列说法正确的是
A. 反应N2(g)+3H2(g)![]() 2NH3(g)的ΔS>0
2NH3(g)的ΔS>0
B. 地下钢铁管道用导线连接铜块可以减缓管道的腐蚀
C. 常温下Ksp[Mg(OH)2]=5.6×10-12,含Mg2+溶液中pH=10 时c(Mg2+)≤5.6×10-4 mol·L-1
D. 常温常压下,锌与稀H2SO4反应生成11.2 LH2,反应中转移的电子数为6.02×1023
科目:高中化学 来源: 题型:
【题目】(能力挑战题)已知五种元素的原子序数的大小顺序为C>A>B>D>E;A、C同周期,B、C同主族;A与B形成的离子化合物A2B中所有离子的电子数相同,其电子总数为30,D和E可形成4核10个电子分子。试回答下列问题:
(1)写出五种元素的名称。
A ,B ,C ,D ,E 。
(2)用电子式表示离子化合物A2B的形成过程:_________ ____________。
(3)写出D元素形成的单质的结构式: ____________________。
(4)写出下列物质的电子式:
E与B形成的化合物: ;A、B、E形成的化合物: ;D、E形成的化合物: ___________。
(5)A、B两元素组成的化合物A2B2属于 (填“离子”或“共价”)化合物,存在的化学键是 ,写出A2B2与水反应的化学方程式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿文同学想测定某Cu-Ag合金中两种金属的质量比。称取这种合金9.6g,加入足量AgNO3溶液充分反应后过滤,将所得固体洗涤、干燥后称量,质量为24.8g。
(1)发生反应的化学方程式为______________________。
(2)试计算该合金中铜与银的质量比__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲和乙两种物质混合反应(反应可加热),将所得气体通入适量的丙中,丙中没有明显现象产生的是 ( )
选项 | 甲 | 乙 | 丙 |
A | C | 浓硫酸 | 澄清石灰水 |
B | MnO2 | 稀盐酸 | 品红溶液 |
C | 浓氨水 | 碱石灰 | AlCl3溶液 |
D | Cu | 浓硝酸 | Ba(HSO3)2溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25℃时,0.1mol·L-lCH3COOH的电离度(已电离的CH3COOH分子数/原CH3COOH分子总数)约为1%。该温度下,用0.1000mol·L-l氨水滴定10.00 mL0.1000mol·L-lCH3COOH溶液,溶液的pH与溶液的导电能力(I)的关系如图所示。下列说法正确的是

A. M点→N点,水的电离程度逐渐增大
B. 25℃时,CH3COOH 的电离常数约为1.0×10-2
C. N点溶液中,c(CH3COO-) =c(NH4+)=0.05 mol·L-l
D. 当滴入20 mL氨水时,溶液中c(CH3COO-)>c(NH4+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】S转化为H2SO4有下列两种途径,部分反应条件和产物已省略。
途径①:S![]() H2SO4
H2SO4
途径②:S![]() SO2
SO2![]() SO3
SO3![]() H2SO4
H2SO4
下列有关说法不正确的是 ( )
A. 途径①的反应体现了浓硝酸的强氧化性和酸性
B. 途径②中有两步氧化还原反应
C. 由途径①和②分别制取1 mol H2SO4,理论上各消耗1 mol S,各转移6 mol电子
D. 理论上,途径②相比途径①对环境的污染小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物是严重的大气污染物,可以通过以下方法处理:
Ⅰ.催化还原法:如在汽车排气管上安装一个催化转化器,发生如下反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
(1)已知:N2(g)+O2(g)![]() 2NO(g) △H=+180kJ/mol
2NO(g) △H=+180kJ/mol
化学键 | O=O | C=O | C≡O |
键能(kJ/mol) | 497 | 803 | 1072 |
则反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H=________kJ/mol。
N2(g)+2CO2(g) △H=________kJ/mol。
(2)在一定温度下,向体积为1L的密闭容器中充入2molNO、1molCO,10分钟时反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g)达到平衡状态,反应过程中反应物浓度随时间变化情况如图1所示。
N2(g)+2CO2(g)达到平衡状态,反应过程中反应物浓度随时间变化情况如图1所示。
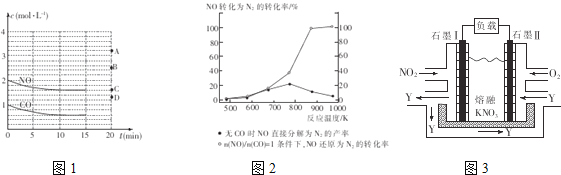
①该反应的平衡常数K的计算式为___________________;前10分钟内用氮气表示的反应速率为____________________。
②若保持温度不变,15分钟时再向该容器中充入1.6molNO、0.4molCO2,则此时反应的
ν正________ν逆(填“>”、“=”或“<”)。
③若保持其他条件不变,15min时压缩容器的体积至0.5L,20分钟时反应重新达到平衡,NO的浓度对应的点应是图1中的________(填字母)。
④某科研小组研究发现以Ag-ZSM-5为催化剂,NO转化为N2的转化率随温度变化情况如图2所示。若不使用CO,温度超过775K,发现NO的分解率降低,其可能的原因是_________________________________________。
Ⅱ.利用电化学原理,将NO2、O2和熔融KNO3制成燃料电池,其原理如图3,该电池在工作过程中NO2转变成绿色硝化剂Y,Y是一种氧化物,可循环使用,石墨Ⅱ是电池的___极,石墨Ⅰ附近发生的反应电极反应式为______________________相同条件下,消耗的O2和 NO2的体积比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从柑橘中可提炼得1,8萜二烯(![]() ).下列有关它的说法正确的是( )
).下列有关它的说法正确的是( )
A. 分子式为C10H14
B. 属于烃,难溶于水,可用某些有机溶剂提取1,8萜二烯
C. 与酸性高锰酸钾溶液、氧气、溴水等均可发生氧化反应
D. 它的一种同分异构体的结构中可能含有苯环
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com