
����Ŀ�����������������صĴ�����Ⱦ�����ͨ�����·���������
����ԭ�������������������ϰ�װһ����ת�������������·�Ӧ��2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
��1����֪��N2(g)+O2(g)![]() 2NO(g) ��H=+180kJ/mol
2NO(g) ��H=+180kJ/mol
��ѧ�� | O=O | C=O | C��O |
����(kJ/mol) | 497 | 803 | 1072 |
��Ӧ��2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ��H=________kJ/mol��
N2(g)+2CO2(g) ��H=________kJ/mol��
��2����һ���¶��£������Ϊ1L���ܱ������г���2molNO��1molCO��10����ʱ��Ӧ2NO(g)+2CO(g)![]() N2(g)+2CO2(g)�ﵽƽ��״̬����Ӧ�����з�Ӧ��Ũ����ʱ��仯�����ͼ1��ʾ��
N2(g)+2CO2(g)�ﵽƽ��״̬����Ӧ�����з�Ӧ��Ũ����ʱ��仯�����ͼ1��ʾ��
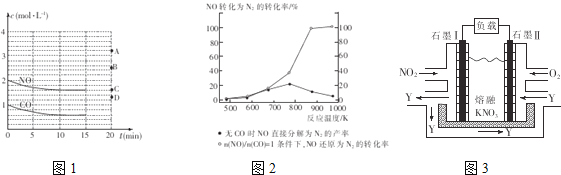
�ٸ÷�Ӧ��ƽ�ⳣ��K�ļ���ʽΪ___________________��ǰ10�������õ�����ʾ�ķ�Ӧ����Ϊ____________________��
���������¶Ȳ��䣬15����ʱ����������г���1.6molNO��0.4molCO2�����ʱ��Ӧ��
����________����(���������=������)��
�������������������䣬15minʱѹ�������������0.5L��20����ʱ��Ӧ���´ﵽƽ�⣬NO��Ũ�ȶ�Ӧ�ĵ�Ӧ��ͼ1�е�________(����ĸ)��
��ij����С���о�������Ag-ZSM-5Ϊ������NOת��ΪN2��ת�������¶ȱ仯�����ͼ2��ʾ������ʹ��CO���¶ȳ���775K������NO�ķֽ��ʽ��ͣ�����ܵ�ԭ����_________________________________________��
�����õ绯ѧԭ������NO2��O2������KNO3�Ƴ�ȼ�ϵ�أ���ԭ����ͼ3���õ���ڹ���������NO2ת�����ɫ������Y��Y��һ���������ѭ��ʹ�ã�ʯī���ǵ�ص�___����ʯī�������ķ�Ӧ�缫��ӦʽΪ______________________��ͬ�����£����ĵ�O2�� NO2�������Ϊ__________��
���𰸡� ��751 ![]() 0.02mol/��Lmin�� = B NO�ķֽⷴӦΪ���ȷ�Ӧ�������¶������ڷ�Ӧ������� �� NO2��e��+NO3���TN2O5 1��4
0.02mol/��Lmin�� = B NO�ķֽⷴӦΪ���ȷ�Ӧ�������¶������ڷ�Ӧ������� �� NO2��e��+NO3���TN2O5 1��4
����������1����Ӧ�ʱ�=��Ӧ���ܼ���-�������ܼ��ܣ����2CO��g��+O2��g��![]() 2CO2��g����H=(497+2��1072-803��4)kJ/mol=-571kJ/mol�����ݸ�˹���ɣ���2CO��g��+O2��g��
2CO2��g����H=(497+2��1072-803��4)kJ/mol=-571kJ/mol�����ݸ�˹���ɣ���2CO��g��+O2��g��![]() 2CO2��g����H=(497+2��1072-803��4)kJ/mol=-571kJ/mol����N2(g)+O2(g)
2CO2��g����H=(497+2��1072-803��4)kJ/mol=-571kJ/mol����N2(g)+O2(g)![]() 2NO(g)��H=+180kJ/mol�����-�ٵã�2NO(g)+2CO(g)
2NO(g)��H=+180kJ/mol�����-�ٵã�2NO(g)+2CO(g)![]() N2(g)+2CO2(g)�������ʱ�ֵ��H��-571kJ/mol-180kJ/mol=-751kJ/mol��
N2(g)+2CO2(g)�������ʱ�ֵ��H��-571kJ/mol-180kJ/mol=-751kJ/mol��
��2���� 2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
��ʼŨ�ȣ�mol/L 2 1 0 0
ת��Ũ�ȣ�mol/L 0.4 0.4 0.4 0.2
ƽ��Ũ�ȣ�mol/L 1.6 0.6 0.4 0.2
�÷�Ӧƽ�ⳣ������ʽK��![]() ��10min��N2ƽ����Ӧ����v��N2����0.2mol/L��10min��0.02mol/��Lmin����
��10min��N2ƽ����Ӧ����v��N2����0.2mol/L��10min��0.02mol/��Lmin����
���������¶Ȳ��䣬15minʱ����������г���1.6molNO��0.4molCO2�����ʱc��NO����3.2mol/L��c��CO����0.6mol/L��c��CO2����0.8mol/L��c��N2����0.2mol/L����Ӧ��Ũ����Ϊ�� ![]()
![]() ��˵����Ӧ�ﵽƽ�⣬��V����V���������������������䣬15minʱѹ��������0.5Lʱ��Ӧ���´ﵽƽ�⣬��ѹƽ�������ƶ���һ������Ũ�����ӣ����ݿ��淴Ӧ�ص㣬���ü�ֵ��֪��COȫ����Ӧ����ƽ���һ������Ũ��Ϊ3mol/L������һ������Ũ��Ӧ����2mol/L��3mol/L֮�䣬��ѡB��������2NO(g)+2CO(g)
��˵����Ӧ�ﵽƽ�⣬��V����V���������������������䣬15minʱѹ��������0.5Lʱ��Ӧ���´ﵽƽ�⣬��ѹƽ�������ƶ���һ������Ũ�����ӣ����ݿ��淴Ӧ�ص㣬���ü�ֵ��֪��COȫ����Ӧ����ƽ���һ������Ũ��Ϊ3mol/L������һ������Ũ��Ӧ����2mol/L��3mol/L֮�䣬��ѡB��������2NO(g)+2CO(g)![]() N2(g)+2CO2(g)��H��0����֪��ӦΪ���ȷ�Ӧ�������¶�ƽ�������ƶ��������ڷ�Ӧ������У�����NO�ķֽ��ʽ��ͣ�
N2(g)+2CO2(g)��H��0����֪��ӦΪ���ȷ�Ӧ�������¶�ƽ�������ƶ��������ڷ�Ӧ������У�����NO�ķֽ��ʽ��ͣ�
��ȼ�ϵ���и�����ͨ��NO2��ʯī��Ϊ�������缫��ӦʽΪNO2��e��+NO3����N2O5��������ͨ��O2��ʯī��Ϊ�������缫��ӦʽΪO2+2N2O5+4e-��4NO3-��1mol�����õ�4mol���ӣ�1mol��������ʧȥ1mol���ӣ�Ҫʹ��ʧ�����غ㣺�����ĵ�O2��NO2�������Ϊ1��4��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�����������ߣ��������ǵ�����ϢϢ��ء�
(1)����H��C��Na��O��Ca����Ԫ�أ���ѡ�����е�Ԫ����д���л�ѧ���
�ٿ���ʳƷ�������������__________ ��
�ڳ����г��õ���__________________ ��
�ۺ����Ƽ�Ƶõ�������____________ ��
�ܺ�������ߵ�������______________ ��
(2)Ǧ������������������ʹ�ù㷺.�乹��ʾ��ͼ��ͼ���ش��������⣺
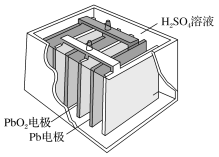
��Ǧ���س��ʱ�ǽ�����ת��Ϊ__________ �ܡ�
��Ǧ���طŵ�����У���Ӧ�Ļ�ѧ����ʽΪ Pb+PbO2+2H2SO4===2PbSO4+2H2O���ݴ˿�֪��Ǧ�����ڷŵ�ʱ����Һ��pH����__________ (����������������С������������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ��ӦN2(g)+3H2(g)![]() 2NH3(g)�Ħ�S>0
2NH3(g)�Ħ�S>0
B. ���¸����ܵ��õ�������ͭ����Լ����ܵ��ĸ�ʴ
C. ������Ksp[Mg(OH)2]=5.6��10-12����Mg2+��Һ��pH=10 ʱc(Mg2+)��5.6��10-4 mol��L-1
D. ���³�ѹ�£�п��ϡH2SO4��Ӧ����11.2 LH2����Ӧ��ת�Ƶĵ�����Ϊ6.02��1023
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)ij��Һ��Cl����Br����I�������ʵ���֮��Ϊ2��3��4��Ҫʹ��Һ�е�Cl����Br����I�������ʵ���֮�ȱ�Ϊ4��3��2����ͨ��Cl2�����ʵ�����ԭ��Һ��I�������ʵ���֮��Ϊ________��
(2)Ҫʹ��Һ��ֻ��Cl����Br������û��I�������ʱCl����Br�������ʵ���֮��Ϊ________��
(3)��Ҫʹ��Һ��ֻ��Cl������ͨ��Cl2�����ʵ�����ԭ��Һ��Br�������ʵ���֮��Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijԪ�ص��Ȼ��ﻯѧʽΪMCl2,�ֽ�11.1 g���Ȼ�������ˮ�����Һ��,����200 mL 1 mol��L-1 AgNO3��Һ���ܰ���Һ����������ȫ��������֪��Mԭ������20������,��:
(1)����M����������д����ԭ����ɷ��š�
(2)ָ��MԪ�������ڱ��е�λ��(���ڡ���)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����̽���һ��Ӧ�ù㷺�ĸй���֬������һ�ֺϳ�·�����£�

��֪��
���� ��R��R��Ϊ�������⣩
��R��R��Ϊ�������⣩
����![]() ��R��R��������
��R��R��������
�ش��������⣺
��1��A�Ļ�ѧ������__________��C�������Ĺ�������________________��
��2��C��D�ķ�Ӧ������____________��E�Ľṹ��ʽΪ_________________��
��3��D+G����̽��Ļ�ѧ����ʽΪ________________________��
��4��T��C��ͬ���칹�壬T�����������ʻ����������ܷ���ˮ�ⷴӦ��������Ӧ�������ڷ����廯�����ҷ��ӽṹ�г�������������������T�Ľṹ��____�֡����к˴Ź�������Ϊ5��壬�ҷ������Ϊ1��1��2��2��2�Ľṹ��ʽΪ______________��
��5����������֪ʶ����������Ϣ��д����CH3CH2OHΪԭ���Ʊ�CH3CH2CH2COOH�ĺϳ�·������ͼ(���Լ�����)�����ϳ�·������ͼʾ�����£�CH2=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH��
CH3CH2OH��
___________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʽΪC3H6ClBr���л��ﹲ��( )��
A. 3�� B. 4�� C. 5�� D. 6��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ����Ԫ�����ڱ���������λ���йص���
A.Ԫ�ص����ԭ������B.ԭ�ӵĺ���������
C.ԭ�ӵĴ���������D.ԭ�ӵĵ��Ӳ���������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ��ѿ���������������ʱ�������������������Ľ����벻�����ǽ������Ϲ衣������Ʒ���õ��赥�ʵ��ǣ� ��
A.�����оƬB.�մɲ;�C.ʯӢ�ӱ�D.���ά
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com