
【题目】某元素的氯化物化学式为MCl2,现将11.1 g该氯化物溶于水配成溶液后,需用200 mL 1 mol·L-1 AgNO3溶液才能把溶液中氯离子完全沉淀。已知该M原子中有20个中子,则:
(1)计算M的质量数并写出其原子组成符号。
(2)指出M元素在周期表中的位置(周期、族)。
科目:高中化学 来源: 题型:
【题目】某溶液中,若忽略水的电离,只含有下表中所示的四种离子,试推测X离子及其个数b可能为( )
离子 | Na+ | Al3+ | Cl﹣ | X |
个数 | 2a | a | a | b |
A.NO3﹣、2a
B.SO42﹣、2a
C.OH﹣、2a
D.SO42﹣、4a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲和乙两种物质混合反应(反应可加热),将所得气体通入适量的丙中,丙中没有明显现象产生的是 ( )
选项 | 甲 | 乙 | 丙 |
A | C | 浓硫酸 | 澄清石灰水 |
B | MnO2 | 稀盐酸 | 品红溶液 |
C | 浓氨水 | 碱石灰 | AlCl3溶液 |
D | Cu | 浓硝酸 | Ba(HSO3)2溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】S转化为H2SO4有下列两种途径,部分反应条件和产物已省略。
途径①:S![]() H2SO4
H2SO4
途径②:S![]() SO2
SO2![]() SO3
SO3![]() H2SO4
H2SO4
下列有关说法不正确的是 ( )
A. 途径①的反应体现了浓硝酸的强氧化性和酸性
B. 途径②中有两步氧化还原反应
C. 由途径①和②分别制取1 mol H2SO4,理论上各消耗1 mol S,各转移6 mol电子
D. 理论上,途径②相比途径①对环境的污染小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
选项 | 实验 | 现象 | 结论 |
A. | 向盛有Fe(NO3)2溶液的试管中加入0.1 mol·L-1 H2SO4溶液 | 试管口出现红棕色气体 | 溶液中NO |
B. | 测定等物质的量浓度的Na2CO3和Na2SO3溶液的pH | 前者pH比后者的大 | 非金属性:S>C |
C. | 向NaHCO3溶液中滴加NaAlO2溶液 | 出现白色沉淀 | 酸性:HCO3->Al(OH)3 |
D. | 向10 mL 0.2 mol·L-1NaOH溶液中滴入2滴0.1 mol·L-1MgCl2溶液,再滴加2滴0.1 mol·L-1FeCl3溶液 | 先有白色沉淀生成后变为红褐色沉淀 | 相同温度下的Ksp:Mg(OH)2>Fe(OH)3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物是严重的大气污染物,可以通过以下方法处理:
Ⅰ.催化还原法:如在汽车排气管上安装一个催化转化器,发生如下反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
(1)已知:N2(g)+O2(g)![]() 2NO(g) △H=+180kJ/mol
2NO(g) △H=+180kJ/mol
化学键 | O=O | C=O | C≡O |
键能(kJ/mol) | 497 | 803 | 1072 |
则反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H=________kJ/mol。
N2(g)+2CO2(g) △H=________kJ/mol。
(2)在一定温度下,向体积为1L的密闭容器中充入2molNO、1molCO,10分钟时反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g)达到平衡状态,反应过程中反应物浓度随时间变化情况如图1所示。
N2(g)+2CO2(g)达到平衡状态,反应过程中反应物浓度随时间变化情况如图1所示。
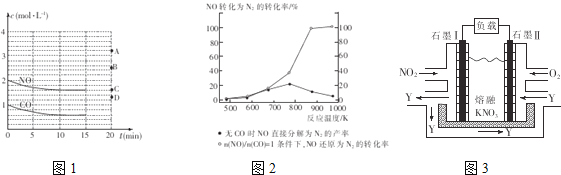
①该反应的平衡常数K的计算式为___________________;前10分钟内用氮气表示的反应速率为____________________。
②若保持温度不变,15分钟时再向该容器中充入1.6molNO、0.4molCO2,则此时反应的
ν正________ν逆(填“>”、“=”或“<”)。
③若保持其他条件不变,15min时压缩容器的体积至0.5L,20分钟时反应重新达到平衡,NO的浓度对应的点应是图1中的________(填字母)。
④某科研小组研究发现以Ag-ZSM-5为催化剂,NO转化为N2的转化率随温度变化情况如图2所示。若不使用CO,温度超过775K,发现NO的分解率降低,其可能的原因是_________________________________________。
Ⅱ.利用电化学原理,将NO2、O2和熔融KNO3制成燃料电池,其原理如图3,该电池在工作过程中NO2转变成绿色硝化剂Y,Y是一种氧化物,可循环使用,石墨Ⅱ是电池的___极,石墨Ⅰ附近发生的反应电极反应式为______________________相同条件下,消耗的O2和 NO2的体积比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小明同学设计了如图所示装置来探究铜跟浓硫酸的反应及气体收集。
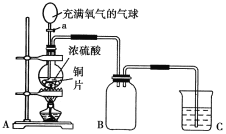
先关闭活塞a,加热至烧瓶中不再有气泡产生时,反应停止,此时烧瓶中铜片仍有剩余。再打开活塞a,将气球中的氧气缓缓挤入烧瓶,铜片慢慢消失。
(1)请写出上述过程A装置中所涉及的化学反应方程式
______________________________________________________________;
(2)张老师认为实验中B装置设计有误,请你帮助小明在装置中进行修改___________。
(3)B装置中所收集到的气体既具有氧化性又具有还原性,请写出一个体现其还原性的化学方程式:______________________,为了验证其漂白性,还可将其通入______试液进行观察。
(4)装置C中应盛放的试剂为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 1mol甲基中含有电子数为10NA
B. 常温下,1LpH=12的Na2CO3溶液中含有的OH-离子数为0.01 NA
C. 标准状况下,NO和O2各11.2L混合充分反应,所得气体的分子总数为0.75 NA
D. 50mL12mol·L-1盐酸和足量MnO2共热,转移的电子数为0.3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水的综合利用可以制备金属镁,其流程如下图所示:
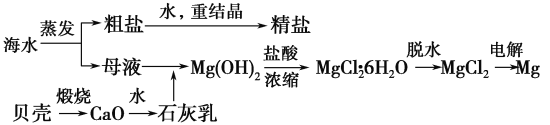
(1)Mg(OH)2沉淀中混有的Ca(OH)2应怎样除去?写出实验步骤。_______________________
(2)实验室将粗盐制成精盐的过程中,溶解、过滤、蒸发三个步骤的操作都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的:
①溶解:_____________________________。
②过滤:_____________________________。
③蒸发:_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com