
【题目】如图是金属镁和卤素单质(X2)反应的能量变化示意图。下列说法正确的是( )
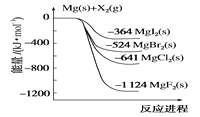
A.由MgCl2制取Mg是放热过程
B.热稳定性:MgI2>MgBr2>MgCl2>MgF2
C.金属镁和卤素单质(X2)的反应都是放热反应
D.由图可知,此温度下MgBr2(s)与Cl2(g)反应的热化学方程式为MgBr2(s)+Cl2(g)→MgCl2(s)+Br2(g)-117kJ
【答案】C
【解析】
A.由图可知,Mg与Cl2的能量高于MgCl2,则由MgCl2制取Mg是吸热反应,故A错误;
B.物质的能量越低越稳定,由图可知化合物的热稳定性顺序为MgI2<MgBr2<MgCl2<MgF2,故B错误;
C.金属镁和卤素单质(X2)的能量均比生成物能量高,则均为放热反应,故C正确;
D.由图可知①Mg(s)+Cl2(l)=MgCl2(s)△H=-641kJ/mol、
②Mg(s)+Br2(l)=MgBr2(s)△H=-524kJ/mol,结合盖斯定律可知,①-②得到MgBr2(s)+Cl2(g)═MgCl2(s)+Br2(g)△H=-117kJmol-1,放热,故D错误;
故答案为C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知短周期元素的离子:aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
A. 原子半径:A>B>D>CB. 原子序数:d>c>b>a
C. 离子半径:C>D>B>AD. 单质的还原性:A>B>D>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氨气、收集、验证其还原性并进行尾气处理的装置和原理能达到实验目的的是
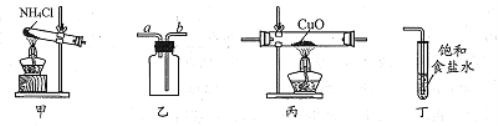
A.用装置甲制取氨气
B.用装置乙收集氨气时气体应该从a口进b口出
C.装置丙中黑色固体变成红色时还原产物一定为铜
D.可以用装置丁吸收氨气,进行尾气处理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素X、Y、Z、M、W的原子序数与其常见化合价的关系如图所示,下列关系不正确的是( )
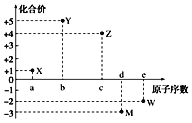
A.元素X可能为锂
B.原子半径大小:r(M)>r(W)
C.X2W中各原子均达到8电子稳定结构
D.元素气态氢化物的稳定性:Y>M
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第3周期某元素的原子,其最外层3p轨道上有一个未成对电子,则关于该元素的描述正确的是( )
A.该元素最高价氧化物的水化物肯定是一种强酸
B.该元素单质可能是一种黄绿色的气体
C.该元素最高价氧化物的水化物肯定是一种强碱,只能与酸反应
D.该元素的原子半径在同周期中肯定是最小的![]() 稀有气体元素除外
稀有气体元素除外![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了科学饮食,了解一些与食品相关的化学知识是必要的。
(1)油炸虾条、薯片等容易挤碎的食品,不宜选用真空袋装,而应采用充气袋装。下列气体中不应该充入的是________(填序号,下同)。
A.氮气 B.二氧化碳
C.空气 D.氧气
(2)为使以面粉为原料的面包松软可口,通常用碳酸氢钠作发泡剂,因为它________。
A.热稳定性差 B.增加甜味
C.产生二氧化碳 D.提供钠离子
(3)能直接鉴别氯化钠和葡萄糖两种未知浓度溶液的方法是________。
A.观察颜色 B.测量比值
C.加热灼烧 D.分别闻味
(4)苯甲酸钠是常用的食品防腐剂,其结构简式如图。以下对苯甲酸钠描述错误的是________。

A.属于盐类 B.能溶于水
C.属于烃类 D.不易分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1molL-1HCl溶液滴定10.0mL浓度为0.1molL-1Na2CO3溶液,所得滴定曲线如图所示。下列微粒浓度大小关系正确的是
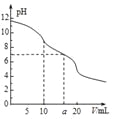
A. 当V=0时:c(H+)+c(HCO3-)+c(H2CO3)=c(OH-)
B. 当V=5时:c(CO32-)+c(HCO3-)+c(H2CO3)=2c(Cl-)
C. 当V=10时:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
D. 当V=a时:c(Na+)=c(Cl-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计了如下实验测定海带中碘元素的含量,依次经过以下四个步骤,下列图示装置和原理能达到实验目的的是
A.灼烧海带
B.将海带灰溶解后分离出不溶性杂质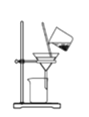
C.制备Cl2,并将I-氧化为I2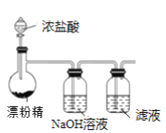
D.以淀粉为指示剂,用Na2SO3标准溶液滴定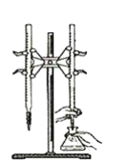
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①0.1 mol/L (NH4)2SO4溶液中各种离子的浓度由大到小顺序为__________。
②用离子方程式表示NaHCO3溶液显碱性的原因:______________。实验室中配制FeCl3溶液时常加入________溶液以抑制其水解。
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)=____________mol/L,在pH=3的CH3COOH溶液中,水电离出的c(H+)=__________ mol/L。
(3)利用反应Cu + H2O2 + H2SO4 = CuSO4 + 2H2O设计一个原电池,回答下列问题:
①负极材料为____________;正极反应式为__________________________。
②反应过程中SO42-向_______极移动。
③当电路中转移0.1mol电子时,电解液质量(不含电极)增加了______克。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com