
【题目】已知短周期元素的离子:aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
A. 原子半径:A>B>D>CB. 原子序数:d>c>b>a
C. 离子半径:C>D>B>AD. 单质的还原性:A>B>D>C
【答案】C
【解析】
四种元素的离子电子层结构相同,它们在周期表中的相对位置如图所示: 。
。
A. A和B的原子核外的电子层数比C和D的原子核外电子层数多一层,所以A和B的原子半径比C和D的原子半径大。A和B在同一周期,电子层数相同,B的核电荷数比A小,所以原子半径B比A大,同理,C的原子半径比D的大,所以原子半径:B>A>C>D,故A不选;
B. 从这四种元素在周期表中的相对位置可以看出,原子序数:a>b>d>c,故B不选;
C. 这四种离子电子层结构相同,所以离子半径只取决于核电荷数,核电荷数越多,半径越小,所以离子半径:C>D>B>A,故C选;
D. 四种元素均为短周期元素,所以B为Na,A为Mg,C为N,D为F。钠的还原性强于镁,F2没有还原性,故D不选。
故选C。


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案科目:高中化学 来源: 题型:
【题目】已知水在25℃和95℃时,其电离平衡曲线如下图所示:

(1)25℃时水的电离平衡曲线应为______(选填“A”或“B”);
(2)25℃时,将pH=9的NaOH溶液与pH=4的盐酸溶液混合,若所得混合溶液的pH=7,则NaOH溶液与盐酸溶液的体积比为________;
(3)95℃时,若100体积pH=a的某强酸溶液与1体积pH=b的某强碱溶液混合后溶液呈中性,则混合前,a与b之间应满足的关系是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(NH4)2Cr2O7可用作有机合成催化剂、媒染剂、显影液等。某化学兴趣小组对(NH4 )2Cr2O7的部分性质及组成进行探究。已知:Cr2O72-(橙色)+ H2O 2CrO42-(黄色)+ 2H+。请回答下列问题:
(1)取少量(NH4)2Cr2O7浓溶液于试管中,滴加足量浓KOH溶液,振荡、微热,观察到的主要现象是______________。
(2)为探究(NH4)2Cr2O7 (摩尔质量为252 g/mol)加热的分解产物,按下图连接好仪器,加热装置略去,在A中加入5.040 g样品进行实验。
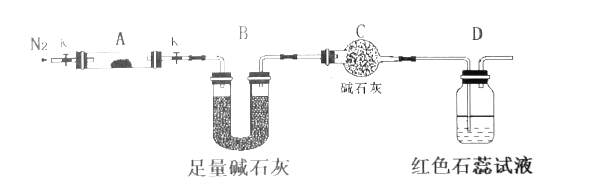
①仪器A的名称是______________。
②连接好装置,点燃酒精灯之前,先通入一段时间N2其目的为___________。
③反应结束后,依然要通一段时间的氮气的原因是________________________。
④加热A至恒重,观察到D中溶液不变色,同时测得A中残留物为Cr2O3、B中质量的变化为1.44 g,写出重铬酸铵加热分解反应的化学方程式:____________________。
(3)实验室常用甲醛法测定含(NH4)2Cr2O7的样品中氮的质量分数(杂质不发生反应),其反应原理为 2Ba2++Cr2O72- + H2O = 2BaCrO 4↓+2H+、4NH4++6HCHO =3H++6H2O+(CH2)6N4H+ [滴定时,1 mo1 (CH2)6N4H+ 与 1 mo1 H+ 相当],然后用 NaOH 标准溶液滴定反应生成的酸。
实验步骤:称取样品5.600 g,配成500 mL溶液,移取25.00 mL样品溶液于 250 mL锥形瓶中,用氯化钡溶液使Cr2O72-完全沉淀后,加入10 mL 20.00 mol·L-1的中性甲醛溶液,摇匀、静置5 min后,加入12滴酚酞试液,用0.200 mo1 L-1 NaOH 标准溶液滴定至终点。重复上述操作3次,最终滴定用去NaOH标准溶液体积的平均值为16.00 mL。
①若滴定终点时,俯视读数,则测定结果_____(填“偏大” “偏小”或“无影响”)。
②滴定计算得该样品中氮的质量分数为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求回答下列问题:
(1)醇的官能团的名称是_____。
(2)某气态有机物相对于氢气的密度为14,则其结构简式为_____。
(3)某有机物的结构简式如图所示,则其一氯代物共有_____种。

(4)新戊烷用系统命名法命名应为_____。
(5)分别将等物质的量的C3H8、C4H8完全燃烧,消耗氧气质量多的是_____(填分子式)。
(6)下列最简式中,只能代表一种有机物的有_____(选填对应的序号)。
①CH3 ②CH2 ③CH2O ④CH4O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,VIA元素单质与H2反应生成气态H2X的热化学方程式如下:
1/2O2(g) + H2(g) =H2O(g) ΔH = -242 kJ·mol-1
S(g) + H2(g) =H2S(g) ΔH = -20 kJ·mol-1
Se(g) + H2(g)![]() H2Se(g) ΔH = +81 kJ·mol-1
H2Se(g) ΔH = +81 kJ·mol-1
下列说法正确的是( )
A. 稳定性:H2O > H2S > H2Se
B. 降温有利于Se与H2反应生成H2Se
C. O2(g) + 2H2S(g)=2H2O(g) + 2S(g) ΔH = 444 kJ·mol-1
D. 随着核电荷数的增加,VIA族元素单质与H2的化合反应越容易发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,反应A2(g)+B2(g)![]() 2AB(g)达到平衡的标志是( )
2AB(g)达到平衡的标志是( )
A.单位时间内生成nmolA2同时生成nmolAB
B.容器内的总压强不随时间的变化而变化
C.单位时间内生成2nmolAB同时生成nmolB2
D.单位时间内生成nmolA2同时生成nmolB2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求。某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即用表面皿盖好。(已知2KMnO4+16HCl(浓)![]() 2KCl+2MnCl2+5Cl2↑+8H2O)
2KCl+2MnCl2+5Cl2↑+8H2O)

(1)e处反应的离子方程式为_________________________________________。该反应中氧化剂和还原剂的物质的量之比为_______________________。
(2) d处的实验现象:__________________________________________。
(3)c处反应的化学方程式为_________________________________。标准状况下,当有0.224 L Cl2被NaOH溶液吸收后,转移电子的物质的量为__________mol。
(4)通过该实验能否比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱?__________(填“能”或“不能” ),若能,其氧化性由强到弱的顺序是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I:现有以下几种物质①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸钠、⑥亚硫酸氢钠、⑦氨水。请回答下列问题:
(1)以上物质属于弱电解质的是______________(填序号);
(2)常温下④的溶液pH_____7(填“>”“<”或“=”),原因__________(用离子方程式表示);
(3)⑥的水溶液中呈酸性,原因是__________________________;
(4)常温下,将aL pH=11的NaOH溶液与bL pH=1的HNO3溶液混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a:b=________。
(5)已知:a.常温下,醋酸和NH3H2O的电离平衡常数均为1.74×10-5;
b.CH3COOH+NaHCO3═CH3COONa+CO2↑+H2O
则CH3COONH4溶液呈______性(填“酸”、“碱”或“中”,下同),NH4HCO3溶液呈______性。
(6)对于醋酸溶液和醋酸钠溶液的下列说法正确的是____________;
A.稀释醋酸溶液,醋酸的电离程度增大,而稀释醋酸钠溶液则醋酸钠的水解程度减小。
B.升高温度可以促进醋酸电离,也可以促进醋酸钠水解。
C.醋酸和醋酸钠混合液中,醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离。
D.常温下,醋酸和醋酸钠等体积等浓度混合,溶液呈碱性。
II:25℃时,向盛有50mL pH=3的HA溶液的绝热容器中加入pH=13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示。
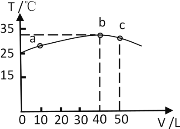
(7)由图可以推出HA溶液的物质的量浓度为_______________,25℃时,pH=3的HA溶液的电离度为______________。
(8)b点溶液中离子浓度由大到小的顺序为_______________________。
(9)加入NaOH溶液至溶液呈中性时出现在图中的位置_________(填“b点前” “b点”或“b点后”),溶液呈中性时,存在:c(A-)______c(Na+)(填“>”“<”或“=”)。
III:(10)已知:Ksp[Al(OH)3]=1×10-33, pH=7.1时Mn(OH)2开始沉淀。室温下,除去MnSO4溶液中的Al3+(使其浓度小于1×10-6 mol·L-1),需调节溶液pH范围为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知草酸为二元弱酸:常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中H2C2O4、HC2O4﹣、C2O42﹣三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是
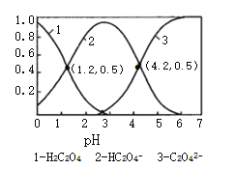
A. pH=1.2溶液中:c(K+)+c(H+)═c(OH﹣)+c(H2C2O4)
B. H2C2O4的第一步电离,平衡常数为10-1.2
C. 将相同物质的量KHC2O4和K2C2O4固体完全溶于水所得混合液的pH为4.2
D. 向pH=1.2的溶液中加KOH溶液将pH增大至4.2的过程中水的电离程度增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com