
【题目】I:现有以下几种物质①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸钠、⑥亚硫酸氢钠、⑦氨水。请回答下列问题:
(1)以上物质属于弱电解质的是______________(填序号);
(2)常温下④的溶液pH_____7(填“>”“<”或“=”),原因__________(用离子方程式表示);
(3)⑥的水溶液中呈酸性,原因是__________________________;
(4)常温下,将aL pH=11的NaOH溶液与bL pH=1的HNO3溶液混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a:b=________。
(5)已知:a.常温下,醋酸和NH3H2O的电离平衡常数均为1.74×10-5;
b.CH3COOH+NaHCO3═CH3COONa+CO2↑+H2O
则CH3COONH4溶液呈______性(填“酸”、“碱”或“中”,下同),NH4HCO3溶液呈______性。
(6)对于醋酸溶液和醋酸钠溶液的下列说法正确的是____________;
A.稀释醋酸溶液,醋酸的电离程度增大,而稀释醋酸钠溶液则醋酸钠的水解程度减小。
B.升高温度可以促进醋酸电离,也可以促进醋酸钠水解。
C.醋酸和醋酸钠混合液中,醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离。
D.常温下,醋酸和醋酸钠等体积等浓度混合,溶液呈碱性。
II:25℃时,向盛有50mL pH=3的HA溶液的绝热容器中加入pH=13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示。
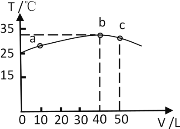
(7)由图可以推出HA溶液的物质的量浓度为_______________,25℃时,pH=3的HA溶液的电离度为______________。
(8)b点溶液中离子浓度由大到小的顺序为_______________________。
(9)加入NaOH溶液至溶液呈中性时出现在图中的位置_________(填“b点前” “b点”或“b点后”),溶液呈中性时,存在:c(A-)______c(Na+)(填“>”“<”或“=”)。
III:(10)已知:Ksp[Al(OH)3]=1×10-33, pH=7.1时Mn(OH)2开始沉淀。室温下,除去MnSO4溶液中的Al3+(使其浓度小于1×10-6 mol·L-1),需调节溶液pH范围为_______。
【答案】② < NH4++H2O![]() NH3·H2O+H+ HSO3—的电离程度大于HSO3—的水解程度 -90:11 中 碱 BC 0.08 mol·L—1 1.25% c(Na+)>c(OH-)>c(A-)>c(H+) b点前 = 5.0<pH<7.1
NH3·H2O+H+ HSO3—的电离程度大于HSO3—的水解程度 -90:11 中 碱 BC 0.08 mol·L—1 1.25% c(Na+)>c(OH-)>c(A-)>c(H+) b点前 = 5.0<pH<7.1
【解析】
(1)氨水是弱电解质;
(2)氯化铵为强酸弱碱盐,在溶液中水解使溶液呈酸性;
(3)亚硫酸氢钠的水溶液中,HSO3—的电离程度大于HSO3—的水解程度;
(4)将aL pH=11的NaOH溶液与bL pH=1的HNO3溶液混合,若所得混合液的pH=2说明HNO3溶液过量,由此计算a:b;
(5)醋酸和一水合氨的电离平衡常数相同,则醋酸根离子和铵根离子水解程度相同,醋酸的酸性强于碳酸,碳酸氢铵溶液中碳酸氢根的水解程度大于铵根离子;
(6)A、稀释促进电离、促进水解;B、电离、水解均为吸热反应;C、醋酸和醋酸钠的混合液中,电离与水解相互抑制;D、醋酸的电离程度大于醋酸钠的水解程度;
(7)b点温度最高,说明HA溶液和氢氧化钠溶液恰好完全反应生成NaA;
(8)NaA是强碱弱酸盐,NaA在溶液中水解使溶液呈碱性;
(9)NaA溶液呈碱性,加入NaOH溶液至溶液呈中性时应为HA和NaA的混合溶液;
(10)运用溶度积公式计算Al3+浓度小于1×10-6 mol·L-1时溶液中c(OH-),再计算溶液pH。
(1)以上物质中,只有氨水是弱电解质,故答案为:②;
(2)氯化铵为强酸弱碱盐,在溶液中水解使溶液呈酸性,溶液pH<7,水解的离子方程式为:NH4++H2O![]() NH3·H2O+H+,故答案为:<;NH4++H2O
NH3·H2O+H+,故答案为:<;NH4++H2O![]() NH3·H2O+H+;
NH3·H2O+H+;
(3)亚硫酸氢钠的水溶液中,HSO3—存在着电离趋势和水解趋势,因为HSO3—的电离程度大于HSO3—的水解程度,溶液呈酸性,故答案为:HSO3—的电离程度大于HSO3—的水解程度;
(4)将aL pH=11的NaOH溶液与bL pH=1的HNO3溶液混合,若所得混合液的pH=2,反应后溶液中氢离子浓度为0.01mol/L,则有(0.1b-0.001a)/(a+b)=0.01,解得a:b=90:11,故答案为:90:11;
(5)醋酸和一水合氨的电离平衡常数相同,则醋酸根离子和铵根离子水解程度相同,所以醋酸铵溶液呈中性,根据反应方程式知醋酸的酸性大于碳酸,则碳酸氢铵溶液中碳酸氢根的水解程度大于铵根离子,则碳酸氢铵溶液呈碱性,故答案为:中;碱;
(6)A、稀释促进电离、促进水解,则稀释时醋酸的电离程度增大,醋酸钠的水解程度增大,故A错误;
B、电离、水解均为吸热反应,升高温度,促进水解和电离,故B正确;
C、醋酸和醋酸钠的混合液中,醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离,二者相互抑制,故C正确;
D、因醋酸的电离平衡常数为1.74×10-5,则水解常数为Kw/Ka=1×10-14/1.74×10-5=
5.74×10-10。常温下,醋酸和醋酸钠等体积等浓度混合,因常数电离程度大于醋酸钠水解程度,溶液呈酸性,故D错误;
故选BC,故答案为:BC;
(7)酸碱中和反应为放热反应,HA溶液和氢氧化钠溶液恰好中和时混合溶液温度最高,由图可知b点恰好完全反应生成NaA,此时消耗氢氧化钠的物质的量为0.04L×0.1mol/L=
0.004mol,则50mlHA溶液的浓度为0.004mol/0.05L=0.08mol/L,pH=3的HA溶液的电离度为0.001mol/0.08mol/L×100%=1.25%,故答案为:0.08mol/L;1.25%;
(8)b点HA溶液和氢氧化钠溶液恰好完全反应生成NaA,NaA是强碱弱酸盐,NaA在溶液中水解使溶液呈碱性,溶液中离子浓度由大到小的顺序为c(Na+)>c(OH-)>c(A-)>c(H+),故答案为:c(Na+)>c(OH-)>c(A-)>c(H+);
(9)由于NaA溶液呈碱性,加入NaOH溶液至溶液呈中性时应为HA和NaA的混合溶液,由于HA未完全反应,则消耗氢氧化钠的体积小于40ml,溶液呈中性时,溶液中c(OH-)=c(H+),由电荷守恒可知c(Na+)=c(A-),故答案为:b点前;=;
(10)Ksp[Al(OH)3]=1×10-33=c(Al3+)×c3(OH-),氢氧化铝完全变成沉淀时c(Al3+)=1×10-6molL-1,解得c(OH-)=1×10-9molL-1,c(H+)=1×10-5molL-1,溶液pH=5,又pH=7.1时Mn(OH)2开始沉淀,则除去MnSO4溶液中的Al3+需调节溶液pH范围为5.0<pH<7.1,故答案为:5.0<pH<7.1。


科目:高中化学 来源: 题型:
【题目】已知短周期元素的离子:aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
A. 原子半径:A>B>D>CB. 原子序数:d>c>b>a
C. 离子半径:C>D>B>AD. 单质的还原性:A>B>D>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,进行可逆反应A(g)+2B(g) ![]() C(g) +D(g),有图Ⅰ、Ⅱ所示的反应曲线,下列说法中不正确的是( )
C(g) +D(g),有图Ⅰ、Ⅱ所示的反应曲线,下列说法中不正确的是( )

A. 正反应是放热反应
B. P1 <P2
C. 若P3<P4,y轴表示A的转化率
D. 若P3>P4,y轴表示C的体积分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】AlPO4的沉淀溶解平衡曲线如图所示(T2>T1)。下列说法错误的是( )

A. AlPO4在b点对应的溶解度大于c点
B. AlPO4沉淀溶解是放热的过程
C. 图中四个点的Ksp:a=c=d<b
D. T1温度下,在饱和溶液中加入AlCl3可使溶液由c点变到a点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用电子式表示H2O和MgBr2的形成过程:___、___。
(2)H2O以___键结合,MgBr2以___键结合。(填极性键、非极性键、离子键)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列有关图象,说法正确的是
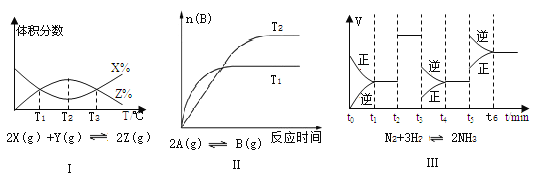
A. 由图Ⅰ知,该反应的△H>0 B. 由图Ⅱ知,该反应为放热反应
C. 由图Ⅲ知,t3时一定是采取降低反应温度的措施 D. 由图Ⅲ知,反应在t6时,NH3体积分数最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一选修5:有机化学基础](15分)聚戊二酸丙二醇酯(PPG)是一种可降解的聚酯类高分子材料,在材枓的生物相容性方面有很好的应用前景。 PPG的一种合成路线如下:

已知:
①烃A的相对分子质量为70,核磁共振氢谱显示只有一种化学环境的氢;
②化合物B为单氯代烃:化合物C的分子式为C5H8;
③E、F为相对分子质量差14的同系物,F是福尔马林的溶质;
④![]() 。
。
回答下列问题:
(1)A的结构简式为 。
(2)由B生成C的化学方程式为 。
(3)由E和F生成G的反应类型为 ,G的化学名称为 。
(4)①由D和H生成PPG的化学方程式为 。
②若PPG平均相对分子质量为10000,则其平均聚合度约为 (填标号)。
a.48 b.58 c.76 d.122
(5)D的同分异构体中能同时满足下列条件的共有 种(不含立体异构):
①能与饱和NaHCO3溶液反应产生气体
②既能发生银镜反应,又能发生皂化反应
其中核磁共振氢谱显示为3组峰,且峰面积比为6:1:1的是 (写结构简式):
D的所有同分异构体在下列—种表征仪器中显示的信号(或数据)完全相同,该仪器是_____(填标号)。
a.质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共振仪
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3.20gNaOH固体露置于空气中一段时间后,部分变质,质量变为6.24g。加水溶解,将溶液分为两等份,一份加入足量Ba(OH)2溶液,充分反应后过滤、洗涤、干燥,称得沉淀质量为1.97g,另一份逐滴滴加1mol·L1盐酸,起初无气体生成,盐酸加入30mL时,开始产生气体,最终产生标准状况下的224mL气体(假设气体全部逸出)。下列说法正确的是( )
A.滴加盐酸时,第一步反应为CO32-+H+=HCO3-
B.变质后固体成分为Na2CO3和NaHCO3
C.变质后固体中Na2CO3的质量m(Na2CO3)=1.06g
D.变质后固体中NaOH的质量分数w(NaOH)=25.6%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com