
����Ŀ��3.20gNaOH����¶���ڿ�����һ��ʱ����ֱ��ʣ�������Ϊ6.24g����ˮ�ܽ⣬����Һ��Ϊ���ȷݣ�һ�ݼ�������Ba(OH)2��Һ����ַ�Ӧ����ˡ�ϴ�ӡ�����Ƶó�������Ϊ1.97g����һ����εμ�1mol��L1���ᣬ������������ɣ��������30mLʱ����ʼ�������壬���ղ�����״���µ�224mL����(��������ȫ���ݳ�)������˵����ȷ���ǣ� ��
A.�μ�����ʱ����һ����ӦΪCO32-+H+=HCO3-
B.���ʺ����ɷ�ΪNa2CO3��NaHCO3
C.���ʺ������Na2CO3������m(Na2CO3)=1.06g
D.���ʺ������NaOH����������w(NaOH)=25.6%
���𰸡�D
��������
3.20gNaOH����¶���ڿ�����һ��ʱ����ֱ��ʣ�������Ϊ6.24g����ˮ�ܽ⣬����Һ��Ϊ���ȷݣ�һ�ݼ�������Ba(OH)2��Һ������1.97g BaCO3�����������ʵ���Ϊ0.01mol�����ݷ�Ӧ����ʽ��Na2CO3+Ba(OH)2=BaCO3��+2NaOH��n(Na2CO3)=0.01mol����ԭ�������n(Na2CO3)=0.02mol��������Ϊm(Na2CO3)=2.12g����һ�ݼ���1mol��L1HCl���տ�ʼ����������������ķ�ӦΪ��NaOH+HCl=NaCl+H2O��Na2CO3+HCl=NaCl+NaHCO3��������������Ϊ30mL�����ĵ���������ʵ���Ϊ0.03mol�����ż������ᣬ�����ķ�ӦΪ��NaHCO3+HCl=NaCl+CO2��+H2O������0.01molCO2�����ĵ�����Ϊ0.01mol���ܹ�����0.04mol���ᣬNaOH����0.02mol���ᣬ���ݷ�Ӧ����ʽ��NaOH+HCl=NaCl+H2O��n(NaOH)=0.02mol�����ˮ�ܽ��Ļ������n(NaOH)=0.04mol��m(NaOH)=1.6g������̼�����Ƶ�����Ϊ��m(NaHCO3)=(6.24-2.12-1.6)g=3.72g�����Ա��ʺ����ɷ�ΪNaOH��Na2CO3 ��NaHCO3��
A. NaOH����¶���ڿ�����һ��ʱ����ֱ��ʣ����Եμ�����ʱ����һ����ӦΪ��OH-+H+=H2O-��A����
B. �����������������ʺ����ɷ�ΪNaOH��Na2CO3 ��NaHCO3��B����
C. ��ˮ�ܽ⣬����Һ��Ϊ���ȷݣ�һ�ݼ�������Ba(OH)2��Һ��������ӦΪ��Na2CO3+Ba(OH)2=BaCO3��+2NaOH������1.97g BaCO3�����������ʵ���Ϊ0.01mol��Na2CO3�����ʵ���Ϊ0.01mol�����Լ�ˮ�ܽ��Ļ����Һ��Na2CO3�����ʵ���Ϊ0.02mol�����ʺ������Na2CO3������m(Na2CO3)=2.12g��C����
D. ���ʺ������NaOH������Ϊ1.6g��NaOH������������![]() ��D��ȷ���ʴ�Ϊ��D��
��D��ȷ���ʴ�Ϊ��D��


 ����Ӣ��ϵ�д�
����Ӣ��ϵ�д� ����ѧУ�ֲ����ܲ�ϵ�д�
����ѧУ�ֲ����ܲ�ϵ�д� �ƸԺ���ȫ�����Ų��Ծ�ϵ�д�
�ƸԺ���ȫ�����Ų��Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I���������¼������ʢ����ᡢ�ڴ��ᡢ���������ơ����Ȼ�李��ݴ����ơ������������ơ��߰�ˮ����ش���������:
��1��������������������ʵ���______________������ţ���
��2�������¢ܵ���ҺpH_____7���>����<����=������ԭ��__________�������ӷ���ʽ��ʾ����
��3����ˮ��Һ�г����ԣ�ԭ����__________________________��
��4��������,��aL pH=11��NaOH��Һ��bL pH=1��HNO3��Һ���(���Ի�Ϻ���Һ����ı仯),�����û����Һ��pH=2����a:b=________��
��5����֪��a�������£������NH3H2O�ĵ���ƽ�ⳣ����Ϊ1.74��10-5��
b��CH3COOH+NaHCO3�TCH3COONa+CO2��+H2O
��CH3COONH4��Һ��______�ԣ���ᡱ��������С�����ͬ����NH4HCO3��Һ��______�ԡ�
��6�����ڴ�����Һ�ʹ�������Һ������˵����ȷ����____________��
A��ϡ�ʹ�����Һ������ĵ���̶�����ϡ�ʹ�������Һ������Ƶ�ˮ��̶ȼ�С��
B�������¶ȿ��Դٽ�������룬Ҳ���Դٽ�������ˮ�⡣
C������ʹ����ƻ��Һ�У��������ƴ����Ƶ�ˮ�⡢������Ҳ���ƴ���ĵ��롣
D�������£�����ʹ����Ƶ������Ũ�Ȼ�ϣ���Һ�ʼ��ԡ�
II��25��ʱ����ʢ��50mL pH=3��HA��Һ�ľ��������м���pH=13��NaOH��Һ������NaOH��Һ�����(V)�����û����Һ���¶�(T)�Ĺ�ϵ��ͼ��ʾ��
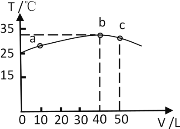
��7����ͼ�����Ƴ�HA��Һ�����ʵ���Ũ��Ϊ_______________��25��ʱ��pH=3��HA��Һ�ĵ����Ϊ______________��
��8��b����Һ������Ũ���ɴ�С��˳��Ϊ_______________________��
��9������NaOH��Һ����Һ������ʱ������ͼ�е�λ��_________���b��ǰ�� ��b�㡱��b�������Һ������ʱ�����ڣ�c(A��)______c(Na��)���>����<����=������
III����10����֪��Ksp[Al(OH)3]��1��10��33�� pH��7.1ʱMn(OH)2��ʼ�����������£���ȥMnSO4��Һ�е�Al3��(ʹ��Ũ��С��1��10��6 mol��L��1)���������ҺpH��ΧΪ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����Ϊ��Ԫ��������£���ijŨ�ȵIJ�����Һ����μ���һ����Ũ�ȵ�KOH��Һ��������Һ��H2C2O4��HC2O4����C2O42�������������ʵ����������ģ�����ҺpH�Ĺ�ϵ��ͼ��ʾ��������˵���в���ȷ����
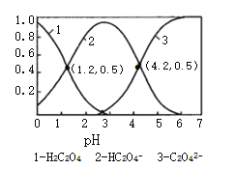
A. pH=1.2��Һ�У�c��K+��+c��H+���Tc��OH����+c��H2C2O4��
B. H2C2O4�ĵ�һ�����룬ƽ�ⳣ��Ϊ10-1.2
C. ����ͬ���ʵ���KHC2O4��K2C2O4������ȫ����ˮ���û��Һ��pHΪ4.2
D. ��pH=1.2����Һ�м�KOH��Һ��pH������4.2�Ĺ�����ˮ�ĵ���̶�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ���ǣ� ��
A.�����£���0.1mol��L��1��HCl��Һ��ˮϡ��10����������Һ��pH=2
B.�����£�pH=3��HCl��Һ��pH=11��NaOH��Һ�У�c(Cl)=c(Na+)
C.0.1mol��L��1��NaOH��Һ������CH3COOH��Һ��ϣ���������Һ�����ԣ���c(CH3COOH)��0.1mol��L��1
D.��������ˮʱ��ˮ�����ӻ�����Kw����c(H+)������c(OH)��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ȼ�������Ʊ������Ļ���ԭ�ϡ���ش�����������
��1������Ȼ���Ʊ��ϳ���(CO��H2)�������ɺϳ�H2C2O4��
�����ӿ�H2C2O4��Һʹ5mL0.01mol/L����KMnO4��Һ��ɫ���ɲ�ȡ�Ĵ�ʩ��__________��_______________(д����)��
�����п���֤��H2C2O4���������___________��
A.H2C2O4���Էֽ�ΪCO��CO2��H2O
B.��������0.1mol/LNaHC2O4��Һ��c(HC2O4-)+c(C2O42-)<0.lmol/L
C.0.1mol/LH2C2O4��Һ25mL��������0.1mol/LNaOH��Һ50mL
D.��������0.05mol/L��H2C2O4��ҺpH��4
��2����֪����CO(g)+H2(g)![]() C(s)+H2O(g) ��H1=-130kJ/mol
C(s)+H2O(g) ��H1=-130kJ/mol
��CH4(g)![]() C(s)+2H2(g) ��H2=+76kJ/mol
C(s)+2H2(g) ��H2=+76kJ/mol
��CO2(g)+H2(g)![]() CO(g)+H20(g) ��H3=+41kJ/mol
CO(g)+H20(g) ��H3=+41kJ/mol
��CH4(g)+CO2(g)![]() 2H2(g)+2CO(g) ��H=________��
2H2(g)+2CO(g) ��H=________��
��3����2L������ͨ��3molCO2��3molCH4���ڲ�ͬ�¶����������Ͻ�Ϊ������������Ӧ��CH4(g)+CO2(g)![]() 2H2(g)+2CO(g)��ƽ����ϵ��CH4��CO2�������������ͼ��
2H2(g)+2CO(g)��ƽ����ϵ��CH4��CO2�������������ͼ��
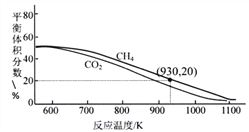
�������¸÷�Ӧ���Է����е�ԭ����______________��930Kʱ��ƽ�ⳣ��K=___________(������λС��)��
�������ͼ���������¶ȱ仯��ԭ��______________��
����700��1100K����ͬ�¶���ƽ��ת������CO2________CH4(�������������� С��������������)�������2���ṩ�ķ�Ӧ��������ԭ�������______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ����������ȼ�ϵ����ˮ����ϵͳԭ������ͼ��ʾ��ͼ�к��ӷ�ˮ���л������C6H6O��ʾ�����С����Ҽ�ֱ������ӽ���Ĥ�ָ�������˵������ȷ���ǣ� ��
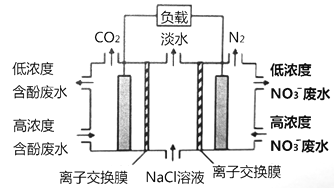
A. ��ص�pHֵ����
B. �ұ�Ϊ�����ӽ���Ĥ
C. �ҳص缫�ķ�Ӧʽ��2NO3-+10e-+12H+= N2��+ 6H2O
D. ������0.1molC6H6O���ڱ�״���½�����0.28mol����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧԭ����������и���
(1)�ӻ�ѧ���ĽǶȷ�������ѧ��Ӧ�Ĺ��̾��Ǿɼ����Ѻ��¼����γɹ��̡���֪��Ӧ��N2(g)+ 3H2(g)![]() 2NH3(g) ��H=��93kJ/mol���Ը��ݱ������м������ݣ�����a ����ֵΪ____kJ/mol��
2NH3(g) ��H=��93kJ/mol���Ը��ݱ������м������ݣ�����a ����ֵΪ____kJ/mol��
��ѧ�� | H��H | N��H | N��N |
����/(kJ/mol) | 436 | a | 945 |
(2)25 ��ʱ����a mol/L��ˮ��0.01 mol/L����������ϣ���Ӧƽ��ʱ��Һ��c(NH4+)=c(Cl-)������Һ��________(��ᡱ������С�)�ԡ��ú�a�Ĵ���ʽ��ʾNH3��H2O�ĵ��볣��Kb��________��
(3)����BaSO4�ı�����Һ��
������Na2SO4��Һ,��c(Ba2+)__________(���������������С����������������ͬ)��
�����ļӸ���Ĺ���BaSO4����c(Ba2+)��__________��
(4)Ŀǰ�ѿ������õ�ⷨ��ȡClO2���¹��ա�

��ͼ����ʯī���缫����һ�������µ�ⱥ��ʳ��ˮ��ȡClO2������������ClO2�ĵ缫��ӦʽΪ___________��
�����һ��ʱ�䣬�������������������Ϊ112 mL (��״��)ʱ��ֹͣ��⡣ͨ�������ӽ���Ĥ�������ӵ����ʵ���Ϊ________mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪͭпԭ��ص�ʾ��ͼ������˵���������
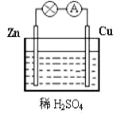
A. һ��ʱ���пƬ���ܽ⣬������С
B. ��װ���ܽ�����ת��Ϊ��ѧ��
C. ��ͭƬ����ʯī�����������Ȳ���
D. ͭ������������ԭ��Ӧ��ֻ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��H2(g)��F2(g)===2HF(g) �������仯��ͼ��ʾ�������й���������ȷ����

A������������ֽ����������ͷ����ķ�Ӧ�Ƿ��ȷ�Ӧ
B��1 mol H2��1 mol F2��Ӧ����2 molҺ̬HF�ų�������С��270 kJ
C������ͬ�����£�1 mol H2��1 mol F2�������ܺʹ���2 mol HF���������
D������1 mol H��H����1 mol F��F �����յ����������γ�2 mol H��F���ų�������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com