
����Ŀ��������ѧԭ����������и���
(1)�ӻ�ѧ���ĽǶȷ�������ѧ��Ӧ�Ĺ��̾��Ǿɼ����Ѻ��¼����γɹ��̡���֪��Ӧ��N2(g)+ 3H2(g)![]() 2NH3(g) ��H=��93kJ/mol���Ը��ݱ������м������ݣ�����a ����ֵΪ____kJ/mol��
2NH3(g) ��H=��93kJ/mol���Ը��ݱ������м������ݣ�����a ����ֵΪ____kJ/mol��
��ѧ�� | H��H | N��H | N��N |
����/(kJ/mol) | 436 | a | 945 |
(2)25 ��ʱ����a mol/L��ˮ��0.01 mol/L����������ϣ���Ӧƽ��ʱ��Һ��c(NH4+)=c(Cl-)������Һ��________(��ᡱ������С�)�ԡ��ú�a�Ĵ���ʽ��ʾNH3��H2O�ĵ��볣��Kb��________��
(3)����BaSO4�ı�����Һ��
������Na2SO4��Һ,��c(Ba2+)__________(���������������С����������������ͬ)��
�����ļӸ���Ĺ���BaSO4����c(Ba2+)��__________��
(4)Ŀǰ�ѿ������õ�ⷨ��ȡClO2���¹��ա�

��ͼ����ʯī���缫����һ�������µ�ⱥ��ʳ��ˮ��ȡClO2������������ClO2�ĵ缫��ӦʽΪ___________��
�����һ��ʱ�䣬�������������������Ϊ112 mL (��״��)ʱ��ֹͣ��⡣ͨ�������ӽ���Ĥ�������ӵ����ʵ���Ϊ________mol��
���𰸡�391 �� ![]() ��С ���� Cl--5e-+2H2O=ClO2����4H+ 0.01
��С ���� Cl--5e-+2H2O=ClO2����4H+ 0.01
��������
(1) ��ѧ��Ӧ���ʱ�=��Ӧ������ܺ�-����������ܺͼ��㣻
(2)���ݵ���غ�������
(3)�ٸ��ݳ����ܽ�ƽ��������ڴӳ����ܽ�ƽ��ƽ�ⳣ��������
(4)����������������Ӧ���������֪�������ӷŵ�����ClO2����Ԫ���غ��֪����ˮ�μӷ�Ӧ����ϵ���غ��֪��ͬʱ���������ӣ�
��������������Ӧ��2H++2e-=H2��������n=![]() �������������ʵ�����ͨ�������ӽ���Ĥ��������Ϊ+1�����ӣ����ݵ���ת���غ���������ӵ����ʵ�����
�������������ʵ�����ͨ�������ӽ���Ĥ��������Ϊ+1�����ӣ����ݵ���ת���غ���������ӵ����ʵ�����
(1) N2(g)+ 3H2(g)![]() 2NH3(g) ��H=��93kJ/mol������ѧ��Ӧ���ʱ�=��Ӧ������ܺ�������������ܺͣ����Կɵã�-93kJ/mol=945kJ/mol+3��436kJ/mol-6��a�����a=391kJ/mol��
2NH3(g) ��H=��93kJ/mol������ѧ��Ӧ���ʱ�=��Ӧ������ܺ�������������ܺͣ����Կɵã�-93kJ/mol=945kJ/mol+3��436kJ/mol-6��a�����a=391kJ/mol��
(2)���ݵ���غ�ɵã�c(H+)+c(NH4+)=c(OH-)+c(Cl-)��������Һ��c(NH4+)=c(Cl-)������c(H+)=c(OH-)����Һ�����ԣ������£�Kw=10-14��c(OH-)=10-7mol/L�������Һ��c(NH3��H2O)=![]() ��c(NH4+)=c(Cl-)=
��c(NH4+)=c(Cl-)=![]() ��10-2mol/L�����Ը�һˮ�ϰ��Ļ�ѧƽ�ⳣ��Kb=
��10-2mol/L�����Ը�һˮ�ϰ��Ļ�ѧƽ�ⳣ��Kb=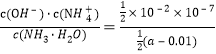 =
=![]() ��
��
(3)��BaSO4����Һ�д��ڳ����ܽ�ƽ�⣺BaSO4(s)![]() Ba2+(aq)+SO42-(aq)������Һ�м���Na2SO4��Һ����Һ��c(SO42-)������ƽ���ƶ�ԭ����֪����ƽ�������ƶ������ﵽƽ��ʱ����Һ��c(Ba2+)��С��
Ba2+(aq)+SO42-(aq)������Һ�м���Na2SO4��Һ����Һ��c(SO42-)������ƽ���ƶ�ԭ����֪����ƽ�������ƶ������ﵽƽ��ʱ����Һ��c(Ba2+)��С��
������ó����ܽ�ƽ���мӸ���Ĺ���BaSO4�������¶Ȳ��䣬�������ӵ�Ũ�Ȳ��䣬����c(Ba2+)��Ũ�Ȳ��䣻
(4)����������������Ӧ���������֪�������ӷŵ�����ClO2����Ԫ���غ��֪����ˮ�μӷ�Ӧ����ϵ���غ��֪��ͬʱ���������ӣ������缫��ӦʽΪ��Cl--5e-+2H2O=ClO2��+4H+��
������������2H++2e--=H2�������������ʵ���Ϊn(H2)=![]()
ͨ�������ӽ���Ĥ��������Ϊ+1�����ӣ��ʽ���Ĥ�������ӵ����ʵ���Ϊ0.005mol��2=0.01mol��


 ��ʦ�㲦��ϵ�д�
��ʦ�㲦��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������й�ͼ��˵����ȷ����
A. ��ͼ��֪���÷�Ӧ�ġ�H>0 B. ��ͼ��֪���÷�ӦΪ���ȷ�Ӧ
C. ��ͼ��֪��t3ʱһ���Dz�ȡ���ͷ�Ӧ�¶ȵĴ�ʩ D. ��ͼ��֪����Ӧ��t6ʱ��NH3����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������26����ʼ���������¶��壬�����ӵ�������NA������ȷֵ6.02214076��1023������˵����ȷ����
A. 18 gT2O�к��е�������Ϊ12NA
B. ��23.5gAgI��ˮ�ƳɵĽ����н���������ĿΪ0.1NA
C. ��״���£�2.24LCl2ȫ������ˮ������Һ�е�Cl����ĿΪ0.1NA
D. 1molij����CnH2n+2��n��1�������к��еĹ��ۼ���Ϊ(3n+1)NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��3.20gNaOH����¶���ڿ�����һ��ʱ����ֱ��ʣ�������Ϊ6.24g����ˮ�ܽ⣬����Һ��Ϊ���ȷݣ�һ�ݼ�������Ba(OH)2��Һ����ַ�Ӧ����ˡ�ϴ�ӡ�����Ƶó�������Ϊ1.97g����һ����εμ�1mol��L1���ᣬ������������ɣ��������30mLʱ����ʼ�������壬���ղ�����״���µ�224mL����(��������ȫ���ݳ�)������˵����ȷ���ǣ� ��
A.�μ�����ʱ����һ����ӦΪCO32-+H+=HCO3-
B.���ʺ����ɷ�ΪNa2CO3��NaHCO3
C.���ʺ������Na2CO3������m(Na2CO3)=1.06g
D.���ʺ������NaOH����������w(NaOH)=25.6%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������в�ͬ�̶ȵĶ��ԣ����ù��ɵ�ط�������ʵ����Ч��������������ŷţ����ỷ����Ⱦ�����ܳ�����û�ѧ�ܣ�������Ӧ 6NO2+ 8NH3= 7N2+12H2O��װ����ͼ��ʾ�����й��ڸõ�ص�˵����ȷ����

A. Ϊʹ��س����ŵ磬���ӽ���Ĥ��ѡ�������ӽ���Ĥ
B. ���Ӵ��Ҳ�缫�������غ��������缫
C. �缫A����ӦʽΪ2NH3 - 6e-=N2 +6H+
D. ����4.48LNO2������ʱ��ת�Ƶ������ʵ���Ϊ 0.8mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�ʵ��װ��ͼ�������У���ȷ����

�� ��
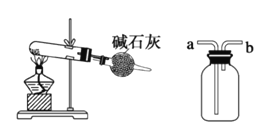
�� ��
A. װ�â٣������ڷ��뻥�����ܵ�Һ������
B. װ�âڣ������������Ȼ��⡢����������β������ֹ����
C. װ�âۣ�������ʵ�������Ȼ��Ϊԭ���Ʊ�����NH3��ʵ��
D. װ�âܣ���װ��ˮ���ٴ�b�ڽ�NO���壬���ռ�NO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ��X�γɵ���̬X2�ķ��ӹ������֣�����Է�����������Ϊ158��160��162�������ַ��ӵ����ʵ���֮��Ϊ9:6:1���ݴˣ�����˵������ȷ����( )
A.X������ͬλ��
B.����һ��ͬλ�ص�������Ϊ80
C.X2��ƽ����Է�������Ϊ159
D.������Ϊ79��ͬλ�ص�ԭ�Ӱٷ���Ϊ50%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��Ӧ����Ϊ�ɼ����Ѻ��¼��γɵĹ��̡���ѧ���ļ������γɣ����ۿ���1 mol��ѧ��ʱ�ͷţ������գ�����������֪����P4O6�ķ��ӽṹ��ͼ��ʾ�����ṩ���»�ѧ���ļ��ܣ�kJ/mol����P��P��198��P��O��360��O��O��498����ӦP4�����ף���3O2=P4O6�ķ�Ӧ����HΪ

A.��1 638 kJ/molB.��1 638 kJ/molC.��126 kJ/molD.��126 kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(CH3OCH3)����һ����ȼ���塣��Ҫ��Ϊ�����Լ����������ƽ���������ҩ��Ⱦ�ϡ�ũҩ��ҵ����������ص���;�����Ʊ�����֮һ����H2��CO�ϳ���2CO(g) + 4H2(g) ![]() CH3OCH3(g) + H2O(g) ��H<0
CH3OCH3(g) + H2O(g) ��H<0
��1���÷�Ӧ����S_____0(������������������������)��
��2���ں��º��������У������жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��������____(ѡ����ĸ���)��
a.�����Ѻ�ˮ����������ȵ���1�U1 b��������ѹǿ���ֲ���
c��������H2����4������CH3OCH3�� d��������һ����̼�����ʵ������ٸı�
��3�����ܱ������У���Ӧ�ﵽƽ������д�ʩ�ܼӿ췴Ӧ���ʲ����COת���ʵ���___(ѡ����ĸ���)��
a����H2O(g)����ϵ�з������ b����С���������ʹ��ϵѹǿ����
c��������ʵĴ��� d��������ϵ�¶�
��4��T��ʱ����2 L�ܱ������У�����4 molCO��8 molH2������Ӧ�����H2�����ʵ�����ʱ��仯��ͼ��״̬��(ͼ��ʵ��)��ʾ��

��T��ʱ����״̬���������£���Ӧ�ﵽC��ʱ��ϵ����ƽ��״̬����H2��ʾ�÷�Ӧ��ƽ��������(H2)=_________�� CO��ת������________����Ӧ��ƽ�ⳣ��K��=_________��
�������ı�ijһ���������H2���ʵ�����ʱ��仯��ͼ״̬����ʾ����K�� _____K��(������������������������)��
�������ı�ijһ����ʱ�����H2�����ʵ�����ʱ��仯��ͼ״̬����ʾ����ı������������_____________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com