
����Ŀ��������(CH3OCH3)����һ����ȼ���塣��Ҫ��Ϊ�����Լ����������ƽ���������ҩ��Ⱦ�ϡ�ũҩ��ҵ����������ص���;�����Ʊ�����֮һ����H2��CO�ϳ���2CO(g) + 4H2(g) ![]() CH3OCH3(g) + H2O(g) ��H<0
CH3OCH3(g) + H2O(g) ��H<0
��1���÷�Ӧ����S_____0(������������������������)��
��2���ں��º��������У������жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��������____(ѡ����ĸ���)��
a.�����Ѻ�ˮ����������ȵ���1�U1 b��������ѹǿ���ֲ���
c��������H2����4������CH3OCH3�� d��������һ����̼�����ʵ������ٸı�
��3�����ܱ������У���Ӧ�ﵽƽ������д�ʩ�ܼӿ췴Ӧ���ʲ����COת���ʵ���___(ѡ����ĸ���)��
a����H2O(g)����ϵ�з������ b����С���������ʹ��ϵѹǿ����
c��������ʵĴ��� d��������ϵ�¶�
��4��T��ʱ����2 L�ܱ������У�����4 molCO��8 molH2������Ӧ�����H2�����ʵ�����ʱ��仯��ͼ��״̬��(ͼ��ʵ��)��ʾ��

��T��ʱ����״̬���������£���Ӧ�ﵽC��ʱ��ϵ����ƽ��״̬����H2��ʾ�÷�Ӧ��ƽ��������(H2)=_________�� CO��ת������________����Ӧ��ƽ�ⳣ��K��=_________��
�������ı�ijһ���������H2���ʵ�����ʱ��仯��ͼ״̬����ʾ����K�� _____K��(������������������������)��
�������ı�ijһ����ʱ�����H2�����ʵ�����ʱ��仯��ͼ״̬����ʾ����ı������������_____________________________��
���𰸡�< a b 0.375mol/��Lmin�� 75% 2.25 = �����¶�
��������
��������Ļ��Ҷȱ仯�ж��ر䣻������������ԭ���жϻ�ѧƽ���ƶ��ķ�����ƽ�ⳣ���Ĺ�ʽ����ƽ�ⳣ����
(1)��Ӧǰ��������ʵ������ڷ�Ӧ����������ʵ���������ϵ���Ҷȼ�С������S<0��
�ʴ�Ϊ��<��
(2) a.�ﵽƽ��ʱ������ֵ�Ũ�Ȳ��ٸı䣬���Dz�һ���ɱ�������a�������⣻
b.�÷�Ӧ������Ӧ�������������С�ķ�Ӧ����������ѹǿ���ٸı䣬˵���÷�Ӧ�Ѵﵽƽ��״̬����b���������⣻
c.��ѧƽ��ʱ����Ӧ����֮��Ӧ����һ������Ӧһ�����淴Ӧ����Ҫ���ڼ�����֮�ȣ���������H2����4������CH3OCH3��ʱ��˵���÷�Ӧ�Ѵﵽƽ��״̬����c������������
d. �ں��º��ݵ������£�������һ����̼�����ʵ������ٸı䣬˵��CO��Ũ�Ȳ��ٸı䣬���ﵽƽ��״̬����d���������⣻
�ʴ�Ϊ��a��
(3)a.��H2O(g)����ϵ�з���������ٽ�ƽ��������Ӧ�����ƶ���COת������ߣ����ǻ�ѧ��Ӧ���ʻ��С����a����
b. ��С���������ʹ��ϵѹǿ����ѹ��������ʣ��ٽ�ƽ�������������С�ķ�������Ӧ�����ƶ���COת������ߣ���b��ȷ��
c.�����ı仯ѧ��Ӧ���ʣ�����Ӱ�컯ѧƽ�⣬��c������
d.�¶����ߴٽ�ƽ�������ȷ�Ӧ�����ƶ����淴Ӧ����CO��ת���ʼ�С����d������
�ʴ�Ϊ��b��
(4) ����ͼ���֪C��ƽ��ʱ��Ӧ��8min������Ӧƽ��ʱ����Ӧ��n(H2)Ϊ8mol-2mol=6mol��ʣ��n(H2)=2mol������(H2)=![]() =0.375mol/��Lmin����
=0.375mol/��Lmin����
���ݷ���ʽ��2CO(g) + 4H2(g) ![]() CH3OCH3(g) + H2O(g)��֪��
CH3OCH3(g) + H2O(g)��֪��
2 4 1 1
��ʼ״̬ 4mol 8mol 0 0
ƽ��ʱ��Ӧ�� 3mol 6mol 1.5mol 1.5mol
ƽ��ʱʣ�� 1mol 2mol 1.5mol 1.5mol
����CO��ת��������CO��=![]() ��K��=
��K��=![]() =
=![]() =2.25��
=2.25��
�ʴ�Ϊ��0.375mol/��Lmin�� ��75%��2.25��
����ͼ���֪��״̬��ﵽƽ���ʱ�����̣���Ӧ���ʼӿ죬��״̬II��ƽ��ʱH2�����ʵ�����״̬Iʱ��С��ƽ��������Ӧ�����ƶ���������ѹǿ������COŨ�ȵ��������ɣ����Dz��������¶ȣ���Ϊ�����¶�ƽ�����淴Ӧ�����ƶ�����״̬II���¶Ȳ��䣬ƽ�ⳣ�����䣬����K�� =K����
�ʴ�Ϊ��=��
�۸���ͼʾ��֪��״̬��ﵽƽ���ʱ�����̣���ƽ�������ƶ������������¶ȣ�ƽ�������ȷ�Ӧ�����ƶ���
�ʴ�Ϊ�������¶ȡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧԭ����������и���
(1)�ӻ�ѧ���ĽǶȷ�������ѧ��Ӧ�Ĺ��̾��Ǿɼ����Ѻ��¼����γɹ��̡���֪��Ӧ��N2(g)+ 3H2(g)![]() 2NH3(g) ��H=��93kJ/mol���Ը��ݱ������м������ݣ�����a ����ֵΪ____kJ/mol��
2NH3(g) ��H=��93kJ/mol���Ը��ݱ������м������ݣ�����a ����ֵΪ____kJ/mol��
��ѧ�� | H��H | N��H | N��N |
����/(kJ/mol) | 436 | a | 945 |
(2)25 ��ʱ����a mol/L��ˮ��0.01 mol/L����������ϣ���Ӧƽ��ʱ��Һ��c(NH4+)=c(Cl-)������Һ��________(��ᡱ������С�)�ԡ��ú�a�Ĵ���ʽ��ʾNH3��H2O�ĵ��볣��Kb��________��
(3)����BaSO4�ı�����Һ��
������Na2SO4��Һ,��c(Ba2+)__________(���������������С����������������ͬ)��
�����ļӸ���Ĺ���BaSO4����c(Ba2+)��__________��
(4)Ŀǰ�ѿ������õ�ⷨ��ȡClO2���¹��ա�

��ͼ����ʯī���缫����һ�������µ�ⱥ��ʳ��ˮ��ȡClO2������������ClO2�ĵ缫��ӦʽΪ___________��
�����һ��ʱ�䣬�������������������Ϊ112 mL (��״��)ʱ��ֹͣ��⡣ͨ�������ӽ���Ĥ�������ӵ����ʵ���Ϊ________mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ǿɵ�����������ʣ�Ҳ����ɿ�����Ⱦ����Ҫ���ʣ��Ӵ�Ե���������������ǻ���������Ҫ�ٴ롣
(1)��һ�������°�������������������ת��Ϊ����Ⱦ�����ʡ�д�������Ͷ���������һ�������·�Ӧ�Ļ�ѧ����ʽ�� _____________________________���÷�Ӧ����������_________����ԭ����________________________________________��
(2)����β���к���CO��NO���������������ʶԴ�������Ⱦ�ķ����ǰ�װ��ת������ʹ���Ƿ�����Ӧ���ɶԴ�������Ⱦ�����壬�÷�Ӧ�Ļ�ѧ����ʽΪ___________________________________��
(3)������������Һ�������շ����еĵ��������Ӧ�Ļ�ѧ����ʽ���£�
NO2��NO��2NaOH===2NaNO2��H2O
2NO2��2NaOH===NaNO2��NaNO3��H2O
����VLijNaOH��Һ����ȫ����nmol NO2��mmol NO��ɵĴ�����Ⱦ�
�������ռ���Һ�����ʵ���Ũ������Ϊ_________ mol��L��1��
����������Һ��c(NO3-)��c(NO2-)��1��9����ԭ���������NO2��NO�����ʵ���֮��n��m��_________��
���ú�n��m�Ĵ���ʽ��ʾ������Һ��NO3-��NO2-Ũ�ȵı�ֵc(NO3-)��c(NO2-)��_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��H2(g)��F2(g)===2HF(g) �������仯��ͼ��ʾ�������й���������ȷ����

A������������ֽ����������ͷ����ķ�Ӧ�Ƿ��ȷ�Ӧ
B��1 mol H2��1 mol F2��Ӧ����2 molҺ̬HF�ų�������С��270 kJ
C������ͬ�����£�1 mol H2��1 mol F2�������ܺʹ���2 mol HF���������
D������1 mol H��H����1 mol F��F �����յ����������γ�2 mol H��F���ų�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���绯ѧԭ��������ת��������ұ���ȷ���Ӧ�ù㷺��
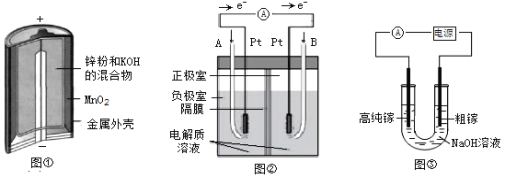
��1��ͼ���Ǽ���п�̵�أ��ڸ���������Ӧ��������__________������Zn������MnO2��������������_________��Ӧ������������������ԭ������
��2��ͼ���Ǽ��Ե���ʵ�����ȼ�ϵ�أ�B��ͨ�������Ϊ________��A�������ĵ缫��Ӧʽ____________________________________________��
��3����ⷨ�����ᴿ���أ�����ԭ����ͼ����ʾ��
�ٴ������Դ___________����������������������������
�����������ܽ����ɵ�Ga3+��NaOH��Һ��Ӧ����GaO2����GaO2���������ŵ�ĵ缫��Ӧʽ______________________________________________________��
��4������������ұ����Ӧ����������õ�ⷨ����________(ѡ����ĸ���)��
a��NaCl b��Fe2O3���� c��Cu2S���� d��Al2O3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�ijˮ��ҺM�д��ڵ�������Na����A2����HA����H����OH����H2O��H2A����������ش��������⣺
��1��H2AΪ_____�ᣨ����ǿ����������������H2A��Һ�м�ˮ��ʹ c(H+)/c(H2A)��ֵ________(����������������С������������)��
��2����M����һ��������ɵ���Һ����M�����ʿ�����Na2A��________��
��Na2A��ˮ��ҺpH________(������������������������)7��
ԭ���ǣ�______________________________�������ӷ���ʽ��ʾ��
����Na2A��Һ�м���_______________��������ˮ��(ѡ����ĸ���)��
a���Ȼ�粒��� b��KOH���� c�� ˮ d�������¶�
����֪Ksp(CuA)��1.3��10��36����20mL 1 mol��L��1Na2A��Һ�м���10 mL 1 mol��L��1 CuCl2��Һ����Ϻ���Һ�е�Cu2��Ũ��Ϊ________mol��L��1��������A2����ˮ�⣩
��3������ҺM��10 mL 1.00 mol��L��1 H2A��Һ��10 mL 1.00 mol��L��1 NaOH��Һ��϶��ɣ����й�����ҺM��˵����ȷ����________(ѡ����ĸ���)��
a��c(A2��) + c(HA��) + c(H2A) �� 1 mol��L��1
b������Һ�����ԣ���c(Na��)��c(HA��) ��c(H��)��c(A2��) ��c(OH��)
c������Ũ�ȹ�ϵ��c(Na��) + c(H��) �� c(OH��) + c(HA��) + c(A2��)
d��25 ��ʱ����ˮϡ�ͺ�n(H��)��n(OH��)�ij˻����
��4��Ũ�Ⱦ�Ϊ0.1 mol �� L��1��Na2A��NaHA�����Һ���� ![]() �� ______ ��
�� ______ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����4molA�����2molB��������1L���ܱ������У���Ϻ������·�Ӧ��2A(g)+B(g)=2C(g)������2s����C��Ũ��Ϊ1.2mol/L������˵����ȷ����()
A.������A��ʾ�ķ�Ӧ����Ϊ1.2mol/(L��s)B.2sʱ����A��ת����Ϊ30��
C.������B��ʾ�ķ�Ӧ����Ϊ0.6mol/(L��s)D.2sʱ����B��Ũ��Ϊ0.6mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����״���£���100 mL H2S������Һ��ͨ��SO2���壬������ҺpH�仯��ͼ��������ʾ��

���з�����ȷ����
A. ԭH2S��Һ�����ʵ���Ũ��Ϊ0.05 mol/L
B. ����������Ա������������ǿ
C. b��ˮ�ĵ���̶ȱ�c��ˮ�ĵ���̶ȴ�
D. a���Ӧ��Һ�ĵ����Ա�d��ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ƥ��һ�ֳ��õ���ҩ�����п�����ʹ�������������á�����Ƥ�ء����京�е�һ����Ч�ɷ֣��ṹ��ʽ����ͼ��ʾ���й���������������ȷ����
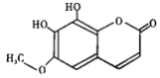
A. 1mol �û������������3 mol NaOH ��Ӧ B. ���л������ʽΪC10H8O5
C. ���л����ܷ����ӳɡ�������ȡ���ȷ�Ӧ D. �����������ֹ�����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com