
【题目】标准状况下,向100 mL H2S饱和溶液中通入SO2气体,所得溶液pH变化如图中曲线所示。

下列分析正确的是
A. 原H2S溶液的物质的量浓度为0.05 mol/L
B. 氢硫酸的酸性比亚硫酸的酸性强
C. b点水的电离程度比c点水的电离程度大
D. a点对应溶液的导电性比d点强
 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或折开)1 mol化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ/mol):P—P:198,P—O:360,O=O:498,则反应P4(白磷)+3O2=P4O6的反应热ΔH为

A.-1 638 kJ/molB.+1 638 kJ/molC.-126 kJ/molD.+126 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3),是一种易燃气体。主要作为甲基化试剂和各类气雾推进剂,在制药、染料、农药工业中有许多独特的用途。其制备方法之一可由H2和CO合成:2CO(g) + 4H2(g) ![]() CH3OCH3(g) + H2O(g) ΔH<0
CH3OCH3(g) + H2O(g) ΔH<0
(1)该反应的ΔS_____0(填“>”、“<”或“=”)。
(2)在恒温恒容容器中,不能判断该反应达到化学平衡状态的依据是____(选填字母序号)。
a.二甲醚和水蒸气的体积比等于1︰1 b.容器中压强保持不变
c.υ正(H2)=4υ逆(CH3OCH3) d.容器中一氧化碳的物质的量不再改变
(3)在密闭容器中,反应达到平衡后下列措施能加快反应速率并提高CO转化率的是___(选填字母序号)。
a.将H2O(g)从体系中分离出来 b.缩小容器体积,使体系压强增大
c.加入合适的催化剂 d.升高体系温度
(4)T℃时,在2 L密闭容器中,充入4 molCO和8 molH2发生反应,测得H2的物质的量随时间变化如图中状态Ⅰ(图中实线)所示:

①T℃时,在状态Ⅰ的条件下,反应达到C点时体系处于平衡状态,以H2表示该反应的平均速率υ(H2)=_________, CO的转化率是________,反应的平衡常数KⅠ=_________。
②若仅改变某一条件,测得H2物质的量随时间变化如图状态Ⅱ所示,则KⅠ _____KⅡ(填“>”、“<”或“=”)。
③若仅改变某一条件时,测得H2的物质的量随时间变化如图状态Ⅲ所示,则改变的条件可能是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见物质A~K之间存在如图所示的转化关系,其中A、D、E、H为单质,请回答下列问题。
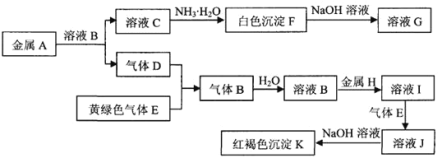
(1)下列物质的化学式是:C______,H______。
(2)反应“I→J”的离子方程式是____。
(3)检验J溶液中的金属离子的方法是(写出操作步骤、现象及结论)____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。已知t ℃时AgCl的Ksp=4×10-10,下列说法正确的是( )
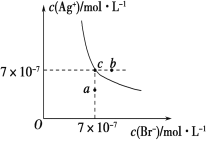
A. 加入NaBr固体,AgBr的溶解度减小,Ksp也减小
B. 在AgBr饱和溶液中加入固体NaBr,可使溶液中c点变到b点
C. 图中a点对应的是有AgBr沉淀生成
D. 在t ℃时,AgCl(s)+Br-(aq) AgBr(s)+Cl-(aq)的平衡常数K≈816
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。
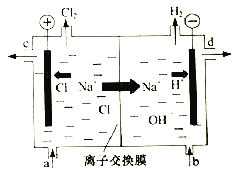
完成下列填空:
(1)写出电解饱和食盐水的离子方程式________________________________。
(2)阳极发生的是____________反应、阴极发生的是________反应(填“氧化”或“还原”)。
(3)精制饱和食盐水从图中________位置补充,氢氧化钠溶液从图中________位置流出。(选填“a”、“b”、“c”或“d”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中有HCHO、H2和O2混合气体共10 g,放入足量Na2O2用电火花引燃,使其完全反应,Na2O2增重4 g,则原混合气体中O2的质量分数是
A.40% B.33.3% C.60% D.36%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe(OH)2由于在空气中易被氧化,制取时很难观察到白色沉淀现象,只能看到灰绿色,采用图装置使用Fe,H2SO4(稀),NaOH溶液可在还原性气氛中制取Fe(OH)2白色沉淀,且较长时间内不变色,其中C为弹簧夹。(提示:还原性气氛如氢气环境)

(1)则锥形瓶A中应加入的药品为________________________。
(2)锥形瓶B中应加入的药品为________________________。
(3)容器A中的反应开始后,请简单写出完成制备Fe(OH)2的后续操作步骤。
___________________________________________________________________。
(4)若在反应开始之前先关闭弹簧夹C,则实验现象为:______________________________;请写出此时B瓶中发生的化学反应的离子方程式:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在恒容密闭容器中充入一定量的H2和CO,在催化剂作用下发生如下反应:CO(g)+2H2(g)![]() CH3OH(g)△H<0。反应达到平衡时,CH3OH体积分数与
CH3OH(g)△H<0。反应达到平衡时,CH3OH体积分数与![]() 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是

A. 反应达平衡时,升高体系温度,CO转化率升高
B. 反应达平衡时,再充入一定量Ar,平衡右移,平衡常数不变
C. 容器内混合气体的密度不再变化说明该反应达到平衡状态
D. ![]() =2.5时达到平衡状态,CH3OH的体积分数可能是图中的F点
=2.5时达到平衡状态,CH3OH的体积分数可能是图中的F点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com