
【题目】Fe(OH)2由于在空气中易被氧化,制取时很难观察到白色沉淀现象,只能看到灰绿色,采用图装置使用Fe,H2SO4(稀),NaOH溶液可在还原性气氛中制取Fe(OH)2白色沉淀,且较长时间内不变色,其中C为弹簧夹。(提示:还原性气氛如氢气环境)

(1)则锥形瓶A中应加入的药品为________________________。
(2)锥形瓶B中应加入的药品为________________________。
(3)容器A中的反应开始后,请简单写出完成制备Fe(OH)2的后续操作步骤。
___________________________________________________________________。
(4)若在反应开始之前先关闭弹簧夹C,则实验现象为:______________________________;请写出此时B瓶中发生的化学反应的离子方程式:_________________________。
【答案】铁和稀硫酸 氢氧化钠溶液 打开弹簧夹C;反应一段时间后关闭弹簧夹C A中液体被压入到B瓶,B瓶内生成白色絮状沉淀,白色沉淀迅速变灰绿,最后变为红褐色; Fe2++2OH-=Fe(OH)2、4Fe(OH)2+O2+2H2O=4Fe(OH)3
【解析】
(1)根据实验目的,锥形瓶A中用铁和稀硫酸反应制取硫酸亚铁,锥形瓶中加入的药品是铁和稀硫酸;(2)硫酸亚铁和氢氧化钠溶液反应生成氢氧化亚铁沉淀,锥形瓶B中盛放的溶液是氢氧化钠溶液;(3)铁和稀硫酸反应生成氢气和硫酸亚铁,为防止锥形瓶内空气的干扰,应先利用产生的氢气将空气排尽,所以A中反应开始后,要打开弹簧夹C,反应一段时间后,要关闭弹簧夹C,利用氢气产生的压强将硫酸亚铁溶液压入锥形瓶B中,使硫酸亚铁和氢氧化钠溶液反应生成氢氧化亚铁白色沉淀;(4)若在反应开始之前先关闭弹簧夹C,A中产生氢气的量逐渐增多,导致压强增大,A中液体被压入B中,硫酸亚铁和氢氧化钠溶液反应生成氢氧化亚铁,锥形瓶B有空气,所以生成的氢氧化亚铁被空气氧化生成红褐色氢氧化铁沉淀,所以看到的现象是A中液体被压入到B瓶,B瓶内生成白色絮状沉淀,白色沉淀迅速变灰绿,最后变为红褐色,B中发生的离子反应方程式为:Fe2++2OH-=Fe(OH)2、4Fe(OH)2+O2+2H2O=4Fe(OH)3。


科目:高中化学 来源: 题型:
【题目】已知:H2(g)+F2(g)===2HF(g) 的能量变化如图所示,下列有关叙述中正确的是

A.氟化氢气体分解生成氢气和氟气的反应是放热反应
B.1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270 kJ
C.在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量
D.断裂1 mol H—H键和1 mol F—F 键吸收的能量大于形成2 mol H—F键放出的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,向100 mL H2S饱和溶液中通入SO2气体,所得溶液pH变化如图中曲线所示。

下列分析正确的是
A. 原H2S溶液的物质的量浓度为0.05 mol/L
B. 氢硫酸的酸性比亚硫酸的酸性强
C. b点水的电离程度比c点水的电离程度大
D. a点对应溶液的导电性比d点强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素的一个原子形成的离子可表示为![]() n-,下列说法正确的是( )
n-,下列说法正确的是( )
A.![]() n-中含有的中子数为a+b
n-中含有的中子数为a+b
B.![]() n-中含有的电子数为a-n
n-中含有的电子数为a-n
C.X原子的质量数为a+b+n
D.一个X原子的质量约为![]() g
g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(9分)
新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2 ,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示。
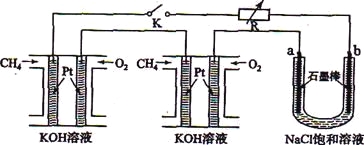
回答下列问题:
(1)甲烷燃料电池正极、负极的电极反应分别为 、 。
(2)闭合K开关后,a、b电极上均有气体产生.其中b电极上得到的是 ,电解氯化钠溶液的总反应方程式为 ;
(3)若每个电池甲烷通入量为1 L(标准状况),且反应完全,则理论上通过电解池的电量为
(法拉第常数F=9.65×l04C.mol-1,列式计算),最多能产生的氯气体积为 L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、D、E、F均为短周期元素(原子序数B<A<F<E<D)。25℃时,其最高价氧化物的水化物(设浓度均为0.001mol/L)溶液的pH和原子半径的关系如图所示。下列说法中正确的是
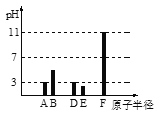
A. A和F的简单离子半径大小顺序:A < F
B. 上述五种元素中有两种元素是金属元素
C. D的最高价氧化物水化物的化学式为HDO3
D. D、E的气态氢化物的稳定性:D > E
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】秦皮是一种常用的中药,具有抗炎镇痛、抗肿瘤等作用。“秦皮素”是其含有的一种有效成分,结构简式如下图所示,有关其性质叙述不正确的是
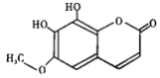
A. 1mol 该化合物最多能与3 mol NaOH 反应 B. 该有机物分子式为C10H8O5
C. 该有机物能发生加成、氧化、取代等反应 D. 分子中有四种官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C在周期表中所处的位置如图所示。A、B、C三种元素原子的质子数和为32。D元素原子的最外层电子数是其次外层电子数的2倍。则下列说法正确的是

A. 元素D的某种同位素质量数为14,则其中子数为6
B. 四种元素形成的气态氢化物中,C元素的氢化物的稳定性最强
C. B、C两种元素可形成BC6型化合物,该化合物属于离子化合物
D. A、B两种元素的气态氢化物均能与它们对应的最高价氧化物对应的水化物发生反应,且都属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究原电池和电解池的工作原理,某研究性学习小组分别用下图所示的装置进行实验。据图回答问题。

I.用图甲所示装置进行第一组实验时:
(1)在保证电极反应不变的情况下,不能替代Cu作电极的是_____ (填字母)。
A石墨 B. 镁 C.银 D.铂
(2)实验过程中,SO42-____(填“从左向右”“从右向左”或“不”)移动;滤纸上能观察到的现象是________________。
II.该小组同学用图乙所示装置进行第二组实验时发现,两极均有气体产生,且Y极处溶液逐渐变成紫红色;停止实验观察到铁电极明显变细,电解液仍然澄清。查阅资料知,高铁酸根(FeO42-)在溶液中呈紫红色。请根据实验现象及所查信息,回答下列问题:
(3)电解过程中,X极处溶液的OH-浓度____(填“增大”“减小”或“不变)。
(4)电解过程中,Y极发生的电极反应为___________________,_________________。
(5)电解进行一段时间后,若在Y电板(铁电极)质量减小2.8g,在Y极收集到气体为1.68 L 则X极收集到气体__________L(均己折算为标准状况时气体体积)。
(6)K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电池反应总反应式为2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,该电池正极发生的电极反应式为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com