
【题目】某元素的一个原子形成的离子可表示为![]() n-,下列说法正确的是( )
n-,下列说法正确的是( )
A.![]() n-中含有的中子数为a+b
n-中含有的中子数为a+b
B.![]() n-中含有的电子数为a-n
n-中含有的电子数为a-n
C.X原子的质量数为a+b+n
D.一个X原子的质量约为![]() g
g
科目:高中化学 来源: 题型:
【题目】装置为锂钒氧化物二次电池,其成本较低,且对环境无污染:V2O5 + xLi![]() LixV2O5;在下图中用该电池电解含镍酸性废水可得到单质镍。下列说法正确的是
LixV2O5;在下图中用该电池电解含镍酸性废水可得到单质镍。下列说法正确的是
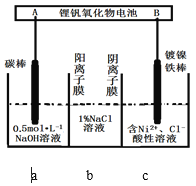
A.该电池充电时,B电极的电极反应式为LixV2O5-xe-=V2O5+xLi+
B.锂钒氧化物二次电池可以用LiCl水溶液作为电解液
C.电解过程中,b中NaCl溶液的物质的量浓度会增大
D.当锂钒氧化物二次电池中有7gLi参与放电时,一定能得到29.35g镍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见物质A~K之间存在如图所示的转化关系,其中A、D、E、H为单质,请回答下列问题。
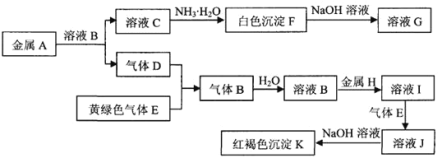
(1)下列物质的化学式是:C______,H______。
(2)反应“I→J”的离子方程式是____。
(3)检验J溶液中的金属离子的方法是(写出操作步骤、现象及结论)____。
查看答案和解析>>
科目:高中化学 来源: 题型:
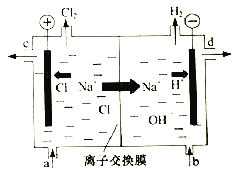
【题目】氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。
完成下列填空:
(1)写出电解饱和食盐水的离子方程式________________________________。
(2)阳极发生的是____________反应、阴极发生的是________反应(填“氧化”或“还原”)。
(3)精制饱和食盐水从图中________位置补充,氢氧化钠溶液从图中________位置流出。(选填“a”、“b”、“c”或“d”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中有HCHO、H2和O2混合气体共10 g,放入足量Na2O2用电火花引燃,使其完全反应,Na2O2增重4 g,则原混合气体中O2的质量分数是
A.40% B.33.3% C.60% D.36%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某元素原子的价电子构型为4s24p1,该元素的符号为________。
(2)某元素+3价离子的3d轨道半充满,该元素的符号为________。
(3)A元素的负二价离子和B元素的正二价离子的电子层结构都与氩相同,A的离子结构示意图为________,B的元素名称为________。
(4)如图,第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的能量。如图是部分元素原子的第一电离能I1随原子序数变化的曲线(其中12~17号元素的有关数据缺失)。
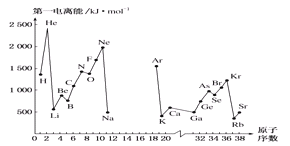
①认真分析图中同周期元素第一电离能的变化规律,推断Na~Ar元素中,Al的第一电离能的大小范围为________<Al<________;(填元素符号)。
②图中第一电离能最小的元素在周期表中的位置是第________周期________族。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe(OH)2由于在空气中易被氧化,制取时很难观察到白色沉淀现象,只能看到灰绿色,采用图装置使用Fe,H2SO4(稀),NaOH溶液可在还原性气氛中制取Fe(OH)2白色沉淀,且较长时间内不变色,其中C为弹簧夹。(提示:还原性气氛如氢气环境)

(1)则锥形瓶A中应加入的药品为________________________。
(2)锥形瓶B中应加入的药品为________________________。
(3)容器A中的反应开始后,请简单写出完成制备Fe(OH)2的后续操作步骤。
___________________________________________________________________。
(4)若在反应开始之前先关闭弹簧夹C,则实验现象为:______________________________;请写出此时B瓶中发生的化学反应的离子方程式:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,四种溶液的pH如下:
① | ② | ③ | ④ | |
pH | 3 | 3 | 11 | 11 |
溶液 | 盐酸 | 醋酸 | NaOH溶液 | 氨水 |
(1)③的溶液中由水电离出c(H+)水·c(OH-)水=______________(mol/L)2。
(2)②中加入少量醋酸钠晶体后,溶液的pH________。(填“增大”、“减小”或“不变”)
(3)②和③两溶液等体积混合,所得溶液中c(Na+)______c(CH3COO-)(填“>”、“<”或“=”)。
(4)若一定体积的①和④恰好完全反应生成氯化铵溶液,该溶液中离子浓度由大到小的顺序是_________________________________。
(5)25℃时,a mol/L醋酸溶液与b mol/LNaOH溶液等体积混合后pH=7,则醋酸的电离常数Ka=__________。(用含a、b的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应对应的离子方程式书写正确的是
A. 饱和碳酸钠溶液中通入足量的二氧化碳:2Na++CO32-+CO2+H2O=2NaHCO3↓
B. KIO3与KI在酸性溶液中反应:5I-+IO3-+3H2O═3I2+6OH-
C. 向Al2(SO4)3溶液中加入过量的氨水:Al3++4NH3·H2O═AlO2-+4NH4++2H2O
D. 饱和石灰水与醋酸溶液混合:Ca(OH)2+2CH3COOH=Ca2++2CH3COO-+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com