
【题目】为了探究原电池和电解池的工作原理,某研究性学习小组分别用下图所示的装置进行实验。据图回答问题。

I.用图甲所示装置进行第一组实验时:
(1)在保证电极反应不变的情况下,不能替代Cu作电极的是_____ (填字母)。
A石墨 B. 镁 C.银 D.铂
(2)实验过程中,SO42-____(填“从左向右”“从右向左”或“不”)移动;滤纸上能观察到的现象是________________。
II.该小组同学用图乙所示装置进行第二组实验时发现,两极均有气体产生,且Y极处溶液逐渐变成紫红色;停止实验观察到铁电极明显变细,电解液仍然澄清。查阅资料知,高铁酸根(FeO42-)在溶液中呈紫红色。请根据实验现象及所查信息,回答下列问题:
(3)电解过程中,X极处溶液的OH-浓度____(填“增大”“减小”或“不变)。
(4)电解过程中,Y极发生的电极反应为___________________,_________________。
(5)电解进行一段时间后,若在Y电板(铁电极)质量减小2.8g,在Y极收集到气体为1.68 L 则X极收集到气体__________L(均己折算为标准状况时气体体积)。
(6)K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电池反应总反应式为2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,该电池正极发生的电极反应式为_______________。
【答案】B 从右向左 滤纸上有蓝色沉淀产生(答出“蓝色沉淀”或“蓝色斑点”即可) 增大 4OH--4e-=2H2O+O2↑ Fe-6e-+8OH-=FeO42-+4H2O 6.72 2FeO42-+6e-+5H2O=Fe2O3+10OH-
【解析】
I.(1)甲装置中左侧为原电池装置,锌作负极,铜作正极,由于需保证电极反应不变,故正极材料的活泼性不能大于Zn,因此不能用镁代替铜;
(2)硫酸根离子向负极移动,移动方向为从右向左移动,M极作阳极,失去电子有铜离子生成,铜离子结合氢氧根离子生成氢氧化铜沉淀;
II.(3)X极作阴极,X极上发生反应:2H++2e-=H2↑,破坏了水的电离平衡,水继续电离,最终导致溶液的c(OH-)增大;
(4)在电解过程中,Y极发生的电极反应为4OH--4e-=2H2O+O2↑和Fe-6e-+8OH-=FeO42-+4H2O;
(5)根据整个电路中电子转移数目相等进行计算;
(6)K2FeO4-Zn碱性电池中,Zn作负极,负极的电极反应式为3Zn-6e-+6OH-=3Zn(OH)2,总电池反应:2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2。用总反应式—负极电极式可得:该电池正极发生的电极反应式为:2FeO42-+6e-+5H2O=Fe2O3+10OH-。
I.(1)甲装置是原电池,Zn作负极,Cu作正极。若要保证电极反应不变,则另一个电极的活动性只要比Zn弱即可。根据金属活动性顺序,Mg>Zn,不能是Mg,故答案为:B。
(2)根据同种电荷相互排斥,异种电荷相互吸引的原则,实验过程中,SO42-会向正电荷较多的Zn电极方向移动。即从右向左移动。此时由于在阳极上发生反应Cu-2e-=Cu2+,产生的Cu2+在溶液中发生反应Cu2++2OH-=Cu(OH)2↓,所以在滤纸上能观察到的现象是有蓝色沉淀产生,故答案为:从右向左,滤纸上有蓝色沉淀产生(答出“蓝色沉淀”或“蓝色斑点”即可)。
II.(3)由图可知:X为阴极。电解过程中,X极上发生反应:2H++2e-=H2↑,破坏了水的电离平衡,水继续电离,最终导致溶液的c(OH-)增大,故答案为:增大。
(4)根据已知条件可知:在电解过程中,Y极发生的电极反应为4OH--4e-=2H2O+O2↑和Fe-6e-+8OH-=FeO42-+4H2O,故答案为:4OH--4e-=2H2O+O2↑,Fe-6e-+8OH-=FeO42-+4H2O。
(5)根据条件可知:n(O2)=1.68L÷22.4L/mol=0.075mol,在整个电路中电子转移数目相等,2n(H2)=4×n(O2)+6×(2.8g÷56g/mol)=0.6mol,n(H2)=0.3mol,即V(H2)=0.3mol×22.4L/mol=6.72L,故答案为:6.72。
(6)K2FeO4-Zn也可以组成碱性电池,Zn作负极,负极的电极反应式为3Zn-6e-+6OH-=3Zn(OH)2,K2FeO4在电池中作为正极材料,电池反应:2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2。用总反应式—负极电极式可得:该电池正极发生的电极反应式为:2FeO42-+6e-+5H2O=Fe2O3+10OH-,故答案为:2FeO42-+6e-+5H2O=Fe2O3+10OH-。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】Fe(OH)2由于在空气中易被氧化,制取时很难观察到白色沉淀现象,只能看到灰绿色,采用图装置使用Fe,H2SO4(稀),NaOH溶液可在还原性气氛中制取Fe(OH)2白色沉淀,且较长时间内不变色,其中C为弹簧夹。(提示:还原性气氛如氢气环境)

(1)则锥形瓶A中应加入的药品为________________________。
(2)锥形瓶B中应加入的药品为________________________。
(3)容器A中的反应开始后,请简单写出完成制备Fe(OH)2的后续操作步骤。
___________________________________________________________________。
(4)若在反应开始之前先关闭弹簧夹C,则实验现象为:______________________________;请写出此时B瓶中发生的化学反应的离子方程式:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在恒容密闭容器中充入一定量的H2和CO,在催化剂作用下发生如下反应:CO(g)+2H2(g)![]() CH3OH(g)△H<0。反应达到平衡时,CH3OH体积分数与
CH3OH(g)△H<0。反应达到平衡时,CH3OH体积分数与![]() 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是

A. 反应达平衡时,升高体系温度,CO转化率升高
B. 反应达平衡时,再充入一定量Ar,平衡右移,平衡常数不变
C. 容器内混合气体的密度不再变化说明该反应达到平衡状态
D. ![]() =2.5时达到平衡状态,CH3OH的体积分数可能是图中的F点
=2.5时达到平衡状态,CH3OH的体积分数可能是图中的F点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应对应的离子方程式书写正确的是
A. 饱和碳酸钠溶液中通入足量的二氧化碳:2Na++CO32-+CO2+H2O=2NaHCO3↓
B. KIO3与KI在酸性溶液中反应:5I-+IO3-+3H2O═3I2+6OH-
C. 向Al2(SO4)3溶液中加入过量的氨水:Al3++4NH3·H2O═AlO2-+4NH4++2H2O
D. 饱和石灰水与醋酸溶液混合:Ca(OH)2+2CH3COOH=Ca2++2CH3COO-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用“Na—CO2”电池可将 CO2 变废为宝。我国科研人员研制出的可充电“Na—CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,放电时总反应的化学方程式为 4Na+3CO2=2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示,下列说法中不正确的是
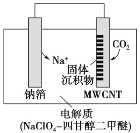
A.电流流向为 MWCNT→导线→钠箔
B.放电时,正极的电极反应式为 3CO2+4Na++4e-=2Na2 CO3+C
C.选用高氯酸钠—四甘醇二甲醚作电解液的优点是导电性好,不与金属钠反应,难挥发
D.原两电极质量相等,若生成的Na2CO3 和C 全部沉积在电极表面,当转移 0.2 mol e-时,两极的质量差为 11.2 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某天然拒食素具有防御非洲大群蚯蚓的作用,其结构简式如图所示(未表示出原子或原子团的空间排列)。该拒食素与下列某试剂充分反应,所得有机物分子的官能团数目增加,则该试剂是

A. H2
B. Ag(NH3)2OH溶液
C. HBr
D. Br2的CCl4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业中很多重要的化工原料都来源于石油化工,如图中的苯、丙烯、有机物 A 等,其中 A 的产量可以用来衡量一个国家的石油化工发展水平。请回答下列问题:

(1)A 的结构简式为_________,丙烯酸中官能团的名称为_________。
(2)写出下列反应的反应类型①_________,②_________。
(3)下列说法正确的是_________。
A.硝基苯中混有浓 HNO3 和 H2SO4,将其倒入到 NaOH 溶液中,静置,分液
B.除去乙酸乙酯中的乙酸,加 NaOH 溶液、分液
C.聚丙烯酸能够使酸性高锰酸钾溶液褪色
D.有机物 C 与丙烯酸属于同系物
(4)写出下列反应方程式:
丙烯酸生成聚丙烯酸:_________。
丙烯酸 + B →丙烯酸乙酯_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由U形管、质量为mg的铁棒、质量为mg的碳棒和1L2mol·L-1CuCl2溶液组成的装置如图所示,下列说法正确的是(假设物质充足)
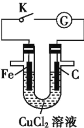
A.闭合K,当电路中有0.3NA个电子通过时,理论上碳棒与铁棒的质量差为18g
B.打开K,碳棒上有紫红色固体析出
C.闭合K,铁棒上发生:Fe-3e―=Fe3+
D.闭合K,铁棒表面发生的电极反应为Cu2++2e―=Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种无机物之间转化关系如下图(反应条件省略。部分产物省略)。下列推断不正确的是
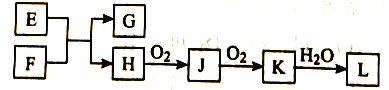
A. 若L为强碱,则E可能为NaCl溶液、F为钾
B. 若L为强酸,则E可能为NaHS、F为HNO3
C. 若L为弱酸,则E可能为Mg、F为CO2
D. 若L为强酸,则E可能为NH4Cl、F为Ca(OH)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com