
【题目】工业中很多重要的化工原料都来源于石油化工,如图中的苯、丙烯、有机物 A 等,其中 A 的产量可以用来衡量一个国家的石油化工发展水平。请回答下列问题:

(1)A 的结构简式为_________,丙烯酸中官能团的名称为_________。
(2)写出下列反应的反应类型①_________,②_________。
(3)下列说法正确的是_________。
A.硝基苯中混有浓 HNO3 和 H2SO4,将其倒入到 NaOH 溶液中,静置,分液
B.除去乙酸乙酯中的乙酸,加 NaOH 溶液、分液
C.聚丙烯酸能够使酸性高锰酸钾溶液褪色
D.有机物 C 与丙烯酸属于同系物
(4)写出下列反应方程式:
丙烯酸生成聚丙烯酸:_________。
丙烯酸 + B →丙烯酸乙酯_________。
【答案】CH2=CH2 碳碳双键、羧基 硝化反应或取代反应 加成反应 A ![]()
 CH2=CHCOOH + CH3CH2OH
CH2=CHCOOH + CH3CH2OH![]() CH2=CHCOOCH2CH3+ H2O
CH2=CHCOOCH2CH3+ H2O
【解析】
本题从B、C反应得乙酸乙酯可知,B为乙醇,再推导A→B为乙烯的加成反应,故A为乙烯;再根据物质所含官能团推测物质的性质。
(1)A 是乙烯,结构简式为CH2=CH2;根据丙烯酸的名称可以推知,含官能团碳碳双键和羧基;
(2)反应①:苯→硝基苯,是苯的取代反应,也叫硝化反应;反应②是乙烯加成生成乙醇;
(3) A.硝基苯中混有浓HNO3和H2SO4,将其倒入到NaOH溶液中,中和剩余的硝酸、硫酸,硝基苯与水溶液不互溶,静置,分液进行分离,故A正确;B.除去乙酸乙酯中的乙酸,加NaOH溶液,乙酸乙酯与氢氧化钠发生反应,故B错误;C.聚丙烯酸没有碳碳双键,不能使酸性高锰酸钾溶液褪色,故C错误;D.有机物C为乙酸,没有碳碳双键,而丙烯酸含有1个碳碳双键,乙酸与丙烯酸含有官能团不完全相同,二者不是同系物,故D错误;答案选A;
(4) 丙烯酸生成聚丙烯酸的化学方程式可根据乙烯生成聚乙烯书写:![]()
 ;丙烯酸 + B →丙烯酸乙酯可根据酯化反应的本质进行书写:CH2=CHCOOH + CH3CH2OH
;丙烯酸 + B →丙烯酸乙酯可根据酯化反应的本质进行书写:CH2=CHCOOH + CH3CH2OH![]() CH2=CHCOOCH2CH3+ H2O。
CH2=CHCOOCH2CH3+ H2O。


科目:高中化学 来源: 题型:
【题目】秦皮是一种常用的中药,具有抗炎镇痛、抗肿瘤等作用。“秦皮素”是其含有的一种有效成分,结构简式如下图所示,有关其性质叙述不正确的是
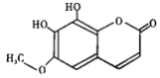
A. 1mol 该化合物最多能与3 mol NaOH 反应 B. 该有机物分子式为C10H8O5
C. 该有机物能发生加成、氧化、取代等反应 D. 分子中有四种官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R、Q、M是六种短周期元素,原子序数依次增大。X是原子半径最小的元素,Y的气态氢化物能使湿润的红色石蕊试纸变蓝,Z为地壳中含量最多的元素,R与X同主族;Y、R、Q最外层电子数之和为8,M的单质为黄绿色有害气体。请回答下列问题:
(1)R在元素周期表中的位置为__________________。
(2)Z、Q、M简单离子半径由大到小的顺序为(写元素离子符号)_____________________。
(3)YX4M的电子式为___________________,Q3Y2与水可剧烈反应,产生沉淀与气体,反应的化学方程式为___________________________________。
(4)X、Z两元素形成的原子个数比为1∶1的化合物的结构式____________。
(5)M的单质与R的最高价氧化物对应的水化物反应的离子方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究原电池和电解池的工作原理,某研究性学习小组分别用下图所示的装置进行实验。据图回答问题。

I.用图甲所示装置进行第一组实验时:
(1)在保证电极反应不变的情况下,不能替代Cu作电极的是_____ (填字母)。
A石墨 B. 镁 C.银 D.铂
(2)实验过程中,SO42-____(填“从左向右”“从右向左”或“不”)移动;滤纸上能观察到的现象是________________。
II.该小组同学用图乙所示装置进行第二组实验时发现,两极均有气体产生,且Y极处溶液逐渐变成紫红色;停止实验观察到铁电极明显变细,电解液仍然澄清。查阅资料知,高铁酸根(FeO42-)在溶液中呈紫红色。请根据实验现象及所查信息,回答下列问题:
(3)电解过程中,X极处溶液的OH-浓度____(填“增大”“减小”或“不变)。
(4)电解过程中,Y极发生的电极反应为___________________,_________________。
(5)电解进行一段时间后,若在Y电板(铁电极)质量减小2.8g,在Y极收集到气体为1.68 L 则X极收集到气体__________L(均己折算为标准状况时气体体积)。
(6)K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电池反应总反应式为2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,该电池正极发生的电极反应式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据图1中氮元素及其化合物的转化关系,回答问题:

(1)实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为_________。
(2)下列试剂不能用于干燥NH3的是__________。
A.浓硫酸 B.碱石灰 C.NaOH固体
(3)工业上以NH3、空气、水为原料生产硝酸分为三步:
①NH3→NO的化学方程式为______________。
②NO→NO2反应的实验现象是____________。
③NO2+H2O→HNO3中氧化剂与还原剂物质的量之比为______。
(4)图1中,实验室只用一种物质将NO直接转化为硝酸且绿色环保,则该物质的化学式为_____。
(5)若要将NH3→N2,从原理上看,下列试剂可行的是______。
A.O2 B.Na C.NH4Cl D.NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置有多种用途,请回答下列问题:

(1)洗气:除去Cl2中的水蒸气,装置内应盛放_____________;
(2)检验:证明CO中混有CO2,装置内应盛放_____________;
(3)集气:若用排空气法收集比空气重的气体时,气体应从装置的_____________端通入(填“A”或“B”,下同);若用排水法收集O2时,瓶内应先装满水,气体从_____________端通入。
(4)贮气:若要用水将装置中的氧气排出进行实验时,水应从_____________端通入。
(5)控制气体流量:医院给病人输O2时,也利用了类似的装置,并在装置中盛放大约半瓶蒸馏水,氧气应从_____________端通入。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制500mL 0.100 mol·Lˉ1的NaCl溶液,部分实验操作示意图如下:
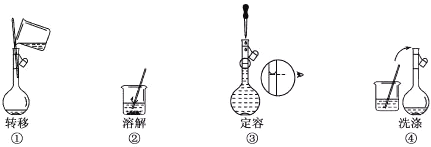
下列说法正确的是
A. 实验中需用的仪器有:天平、250mL容量瓶、烧杯、玻璃棒、胶头滴管等
B. 上述实验操作步骤的正确顺序为①②④③
C. 容量瓶需要用自来水、蒸馏水洗涤,干燥后才可用
D. 定容时,仰视容量瓶的刻度线,使配得的NaCl溶液浓度偏低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将aLNH3完全溶于水得到VmL氨水,溶液的密度为ρg/cm3,溶质的质量分数为ω,溶质的物质的量浓度为cmol/L。下列叙述中正确的是()
①![]()
② ![]()
③ 若上述溶液中再加入VmL水后,所得溶质的质量分数大于0.5ω
④ 若上述溶液中再加入0.5mL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:
c(NH4+)>c(Cl-)>c(OH-)>c(H+)
A.①④ B.②③ C.②④ D.①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某水溶液中可能含有Na+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、SO42-离子中的若干种。某同学取200 mL该溶液分成两等份依次进行如下实验:①向第一份溶液中加过量的NaOH溶液后加热,充分反应后生成0.02 mol气体(标况),无沉淀产生,同时得到溶液甲;②向溶液甲中通入过量的CO2,充分反应生成白色沉淀,沉淀经过滤、洗涤、灼烧至恒重得到1.02 g固体;③向第二份溶液中加入足量的BaCl2溶液,充分反应生成白色沉淀,沉淀用盐酸充分洗涤、干燥,得到11.65 g固体。据此,该同学得到的结论正确的是( )
A. 实验①中产生的气体为氨气,并可得原溶液中c(NH4+)=0.02 mol/L
B. 实验③中的沉淀里一定有BaSO4,可能有Mg(OH)2
C. 若要确定原溶液中是否含有Cl-,无需另外再设计实验验证
D. 原溶液中一定含有Na+,且c(Na+)≥0.2 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com