
【题目】配制500mL 0.100 mol·Lˉ1的NaCl溶液,部分实验操作示意图如下:
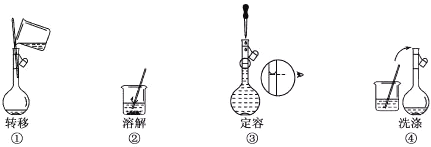
下列说法正确的是
A. 实验中需用的仪器有:天平、250mL容量瓶、烧杯、玻璃棒、胶头滴管等
B. 上述实验操作步骤的正确顺序为①②④③
C. 容量瓶需要用自来水、蒸馏水洗涤,干燥后才可用
D. 定容时,仰视容量瓶的刻度线,使配得的NaCl溶液浓度偏低
【答案】D
【解析】
配制500mL 0.100 mol·Lˉ1NaCl溶液操作步骤有计算、称量、溶解、转移、洗涤、定容、摇匀等操作,用托盘天平(用到药匙)称量氯化钠,在烧杯中溶解,用玻璃棒搅拌,加速溶解,恢复到室温后转移到500mL容量瓶中,并用玻璃棒引流,洗涤2~3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀。
A项、配制500mL 0.100 mol·Lˉ1NaCl溶液用到的仪器有托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管,故A错误;
B项、配制一定物质的量浓度的溶液的步骤有计算、称量、溶解、转移、洗涤、定容、摇匀等,操作步骤正确的顺序为②①④③,故B错误;
C项、容量瓶用蒸馏水洗净后,由于后面还需要加入蒸馏水定容,所以不必干燥,故C错误;
D项、定容时仰视容量瓶的刻度线,则所加蒸馏水偏多,溶液的体积V偏大,溶液的浓度偏低,故D正确。
故选D。


科目:高中化学 来源: 题型:
【题目】某科研人员提出HCHO(甲醛)与O2在羟基磷灰石(HAP)表面催化生成H2O的历程,该历程示意图如下(图中只画出了 HAP的部分结构):
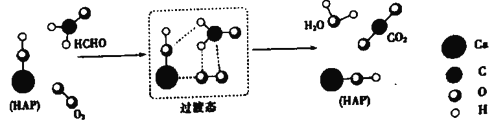
下列说法不正确的是
A. HAP能提高HCHO与O2的反应速率
B. HCHO在反应过程中,有C-H键发生断裂
C. 根据图示信息,CO2分子中的氧原子全部来自O2
D. 该反应可表示为:HCHO+O2![]() CO2+H2O
CO2+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用“Na—CO2”电池可将 CO2 变废为宝。我国科研人员研制出的可充电“Na—CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,放电时总反应的化学方程式为 4Na+3CO2=2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示,下列说法中不正确的是
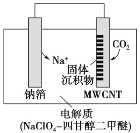
A.电流流向为 MWCNT→导线→钠箔
B.放电时,正极的电极反应式为 3CO2+4Na++4e-=2Na2 CO3+C
C.选用高氯酸钠—四甘醇二甲醚作电解液的优点是导电性好,不与金属钠反应,难挥发
D.原两电极质量相等,若生成的Na2CO3 和C 全部沉积在电极表面,当转移 0.2 mol e-时,两极的质量差为 11.2 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业中很多重要的化工原料都来源于石油化工,如图中的苯、丙烯、有机物 A 等,其中 A 的产量可以用来衡量一个国家的石油化工发展水平。请回答下列问题:

(1)A 的结构简式为_________,丙烯酸中官能团的名称为_________。
(2)写出下列反应的反应类型①_________,②_________。
(3)下列说法正确的是_________。
A.硝基苯中混有浓 HNO3 和 H2SO4,将其倒入到 NaOH 溶液中,静置,分液
B.除去乙酸乙酯中的乙酸,加 NaOH 溶液、分液
C.聚丙烯酸能够使酸性高锰酸钾溶液褪色
D.有机物 C 与丙烯酸属于同系物
(4)写出下列反应方程式:
丙烯酸生成聚丙烯酸:_________。
丙烯酸 + B →丙烯酸乙酯_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2(g)+O2(g)=2NO(g)的能量变化如图所示。已知:断开1mol N2(g)中化学键需吸收946kJ能量,断开1mol O2(g)中化学键需吸收498kJ能量。

下列说法正确的是
A. N2(g)+O2(g)=2NO(g) △H=-180![]()
B. NO(g)=1/2N2(g)+1/2O2(g) △H=+90![]()
C. 断开1mol NO(g)中化学键需要吸收632kJ能量
D. 形成1 mol NO(g)中化学键可释放90kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由U形管、质量为mg的铁棒、质量为mg的碳棒和1L2mol·L-1CuCl2溶液组成的装置如图所示,下列说法正确的是(假设物质充足)
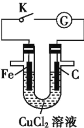
A.闭合K,当电路中有0.3NA个电子通过时,理论上碳棒与铁棒的质量差为18g
B.打开K,碳棒上有紫红色固体析出
C.闭合K,铁棒上发生:Fe-3e―=Fe3+
D.闭合K,铁棒表面发生的电极反应为Cu2++2e―=Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BE是现代有机化工重要的单体之一,工业上采取乙苯催化脱氢制苯乙烯反应制备:
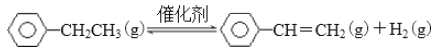
(1)已知:
化学键 | C-H | C-C | C=C | H-H |
键能/ | 412 | 348 | 612 | 436 |
计算上述反应的![]() _______
_______![]() 。该反应能够发生的原因是______
。该反应能够发生的原因是______
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应。已知乙苯的平衡转化率为![]() ,则在该温度下反应的平衡常数K=_______(用a等符号表示)。
,则在该温度下反应的平衡常数K=_______(用a等符号表示)。
(3)工业上,通常在乙苯蒸气中掺混水蒸气,控制反应温度600℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了![]() 以外的产物中苯乙烯的物质的量分数)示意图如图所示:
以外的产物中苯乙烯的物质的量分数)示意图如图所示:
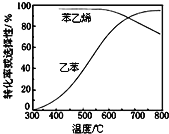
a.掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实__________。
b.控制反应温度为![]() 的理由是___________
的理由是___________
(4)在逆过程苯乙烯加氢制乙苯的操作中,如果氢气中混有![]() 和
和![]() 等杂质,会引起催化剂中毒,因此必须除去。在常温下,可以用银氨溶液来检测微量的
等杂质,会引起催化剂中毒,因此必须除去。在常温下,可以用银氨溶液来检测微量的![]() ,其原理与银镜反应相似,有银析出,写出银氨溶液与
,其原理与银镜反应相似,有银析出,写出银氨溶液与![]() 反应的离子方程式________________。
反应的离子方程式________________。
(5)苯乙烯废气在工业上常用电催化氧化处理,原理如图所示:
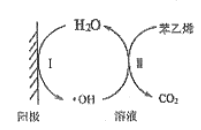
写出阳极电极反应式I为______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下将1 mol N2和3 mol H2置于密闭容器中发生反应N2+3H2![]() 2NH3(正反应是放热反应)。下列关于该反应的说法正确的是
2NH3(正反应是放热反应)。下列关于该反应的说法正确的是
A. 降低温度可以加快反应速率
B. 达到化学反应限度时,生成2mol NH3
C. 向容器中再加入N2可以加快反应速率
D. 1mol N2 和3mol H2的总能量低于2mol NH3的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. ![]() 互为同系物
互为同系物
B. ![]() 的系统命名是2-甲基-1-丙醇
的系统命名是2-甲基-1-丙醇
C. 相同压强下的沸点:乙醇>乙二醇>丙烷
D. 室温下,在水中的溶解度:甘油>苯酚> 1-氯丁烷
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com