
【题目】BE是现代有机化工重要的单体之一,工业上采取乙苯催化脱氢制苯乙烯反应制备:
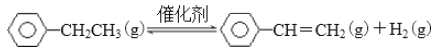
(1)已知:
化学键 | C-H | C-C | C=C | H-H |
键能/ | 412 | 348 | 612 | 436 |
计算上述反应的![]() _______
_______![]() 。该反应能够发生的原因是______
。该反应能够发生的原因是______
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应。已知乙苯的平衡转化率为![]() ,则在该温度下反应的平衡常数K=_______(用a等符号表示)。
,则在该温度下反应的平衡常数K=_______(用a等符号表示)。
(3)工业上,通常在乙苯蒸气中掺混水蒸气,控制反应温度600℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了![]() 以外的产物中苯乙烯的物质的量分数)示意图如图所示:
以外的产物中苯乙烯的物质的量分数)示意图如图所示:
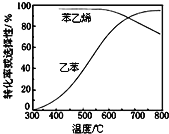
a.掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实__________。
b.控制反应温度为![]() 的理由是___________
的理由是___________
(4)在逆过程苯乙烯加氢制乙苯的操作中,如果氢气中混有![]() 和
和![]() 等杂质,会引起催化剂中毒,因此必须除去。在常温下,可以用银氨溶液来检测微量的
等杂质,会引起催化剂中毒,因此必须除去。在常温下,可以用银氨溶液来检测微量的![]() ,其原理与银镜反应相似,有银析出,写出银氨溶液与
,其原理与银镜反应相似,有银析出,写出银氨溶液与![]() 反应的离子方程式________________。
反应的离子方程式________________。
(5)苯乙烯废气在工业上常用电催化氧化处理,原理如图所示:
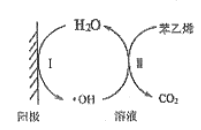
写出阳极电极反应式I为______________
【答案】+124 ![]()
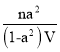 正反应气体分子数增加,水蒸气起稀释作用,相当于减压的效果 600℃,乙苯的转化率和苯乙烯的选择性均较高 2[Ag(NH3)2]OH+CO=(NH4)2CO3+2Ag↓+2NH3 H2O-e-=-OH+H+
正反应气体分子数增加,水蒸气起稀释作用,相当于减压的效果 600℃,乙苯的转化率和苯乙烯的选择性均较高 2[Ag(NH3)2]OH+CO=(NH4)2CO3+2Ag↓+2NH3 H2O-e-=-OH+H+
【解析】
(1)反应热=反应物总键能-生成物总能键能,由有机物的结构可知,应是-CH2CH3中总键能与-CH=CH2、H2总键能之差;该反应能够发生的原因是△H-T△S<0;
(2)用三行式分析各物质的平衡值,再根据平衡常数表达式K=c(苯乙酸)×c(H2)/c(乙苯)计算;
(3)a.保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向气体体积增大的方向移动;
b.600℃时乙苯的转化率与苯乙烯的选择性均较高;结合温度对乙苯转化率、苯乙烯选择性、温度对反应速率与催化剂的影响及消耗能量等,分析控制反应温度为600℃的理由;
(4)银氨溶液将CO氧化,生成银和碳酸根;
(5)由图I为阳极水失电子被氧化生成羟基和氢离子;
(1)反应热=反应物总键能-生成物总能键能,由有机物的结构可知,应是-CH2CH3中总键能与-CH=CH2、H2总键能之差,故△H=(5×412+348-3×412-612-436)kJ·mol-1=+124kJ·mol-1;
该反应能够发生的原因是△H-T△S<0,现△H>0,故△S>0;
(2)物质的量为n、体积为V的乙苯蒸气发生催化脱氢反应参加反应的乙苯为nα mol,则:
![]()
![]()
![]() +H2
+H2
开始(mol):n 0 0
转化(mol):nα nα nα
平衡(mol):n(1-α) nα nα
维持体系总压强p恒定,在温度T时,由PV=nRT可知,混合气体总浓度不变,设反应后的体积为V′,则
[n(1-α)+nα+nα]/V′=n/V,故V′=(1+α)V,则平衡常数K=c(苯乙酸)×c(H2)/c(乙苯),则K= ;
;
(3)a.正反应为气体分子数增大的反应,保持压强不变,加入水蒸气,容器体积应增大,等效为降低压强,平衡向正反应方向移动,提高乙苯的平衡转化率,
b.600℃时乙苯的转化率与苯乙烯的选择性均较高,温度过低,反应速率较慢,转化率较低,温度过高,选择性下降,高温下可能使催化剂失去活性,且消耗能量较大,故选择600℃左右;
(4)银氨溶液将CO氧化,生成银和碳酸根,银氨溶液与![]() 反应的离子方程式2[Ag(NH3)2]OH+CO=(NH4)2CO3+2Ag↓+2NH3;
反应的离子方程式2[Ag(NH3)2]OH+CO=(NH4)2CO3+2Ag↓+2NH3;
(5)由图I为阳极水失电子被氧化生成羟基和氢离子:H2O-e-=-OH+H+。


科目:高中化学 来源: 题型:
【题目】某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。利用如图装置可验证同主族元素非金属性的变化规律

(1)仪器A的名称为_____,干燥管D的作用为__________。
(2)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液____(填现象),即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用____溶液吸收尾气。
(3)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液_______(填现象),即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰试验,应在两装置间添加装有______溶液的洗气瓶除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据图1中氮元素及其化合物的转化关系,回答问题:

(1)实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为_________。
(2)下列试剂不能用于干燥NH3的是__________。
A.浓硫酸 B.碱石灰 C.NaOH固体
(3)工业上以NH3、空气、水为原料生产硝酸分为三步:
①NH3→NO的化学方程式为______________。
②NO→NO2反应的实验现象是____________。
③NO2+H2O→HNO3中氧化剂与还原剂物质的量之比为______。
(4)图1中,实验室只用一种物质将NO直接转化为硝酸且绿色环保,则该物质的化学式为_____。
(5)若要将NH3→N2,从原理上看,下列试剂可行的是______。
A.O2 B.Na C.NH4Cl D.NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制500mL 0.100 mol·Lˉ1的NaCl溶液,部分实验操作示意图如下:
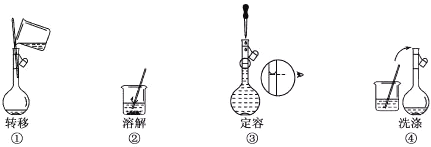
下列说法正确的是
A. 实验中需用的仪器有:天平、250mL容量瓶、烧杯、玻璃棒、胶头滴管等
B. 上述实验操作步骤的正确顺序为①②④③
C. 容量瓶需要用自来水、蒸馏水洗涤,干燥后才可用
D. 定容时,仰视容量瓶的刻度线,使配得的NaCl溶液浓度偏低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为将含有的FeCl3、FeCl2、CuCl2的废液中的Cu2+还原回收,某同学在含有ag铁粉的容器中加入废液,探究了加入废液体积与完全反应后体系中固体质量的关系,部分实验数据如下表所示。已知:废液中c(Cu2+)=0.7 mol·Lˉ1;废液体积大于0.5L,充分反应后才能检测出Cu2+。

下列说法不正确的是
A. 当铁粉与0.25L废液反应完全后,固体成分为Fe与Cu
B. 当铁粉与1L废液反应完全后,再加入废液时发生的离子反应为Fe +2Fe3+=3Fe2+
C. 废液中c(Fe3+)=0.2 mol·Lˉ1
D. 要将1L废液中的Cu2+全部还原,则至少需要铁粉44.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将aLNH3完全溶于水得到VmL氨水,溶液的密度为ρg/cm3,溶质的质量分数为ω,溶质的物质的量浓度为cmol/L。下列叙述中正确的是()
①![]()
② ![]()
③ 若上述溶液中再加入VmL水后,所得溶质的质量分数大于0.5ω
④ 若上述溶液中再加入0.5mL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:
c(NH4+)>c(Cl-)>c(OH-)>c(H+)
A.①④ B.②③ C.②④ D.①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 0.1 molL﹣1的KI溶液:Na+、Ag+、NO3﹣、SO42﹣
B. 使甲基橙变红色的溶液:NH4+、Cu2+、ClO﹣、Cl﹣
C. c(OH﹣)=0.1mol/L的溶液:Na+、K+、CO32﹣、ClO﹣
D. 0.1 molL﹣1的KMnO4溶液:Na+、K+、Cl﹣、SO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝及其化合物在生产生活中有着广泛的用途。
Ⅰ.高岭土化学组成为:Al2O3(25%~34%)、SiO2(40%~50%)、Fe2O3(0.5%~3.0%)以及少量杂质和水分。聚合氯化铝是一种新型、高效絮凝剂和净水剂,其单体是液态的碱式氯化铝[Al2(OH)nCl6-n]。用高岭土制备碱式氯化铝的工艺流程如下:

根据流程图回答下列问题:
(1)实验室配制4mol/L的盐酸1000mL需要用到的玻璃仪器有烧杯、玻璃棒、量筒、____________________等。
(2)加适量铝粉时所发生的离子反应方程式为________________________________。
Ⅱ.铝和镁的碱式碳酸盐(AlxMgy(OH)z(CO3)w·nH2O)是一种中和胃酸过多的常用药物,某化学兴趣小组通过以下实验探究该药物主要成分的化学式:
甲同学取该碱式盐9.03 g充分灼烧至恒重,测得剩余固体质量为5.13 g;
乙同学取相同质量的碱式盐使其溶于足量的盐酸中,收集到气体体积为336mL(已换算为标准状况);继续向溶液中加入足量的NaOH溶液得到5.22 g白色沉淀。试通过计算确定该碱式碳酸盐的化学式________。(写出计算过程,只有答案不给分)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产生活中的许多现象或应用都与化学知识有关。下列现象或应用与胶体性质无关的是
A. 将盐卤或石膏加入豆浆中,制成豆腐
B. 冶金厂常用高压电除去烟尘,是因为烟尘微粒带电荷
C. 泡沫灭火器中将Al2(SO4)3与NaHCO3溶液混合后,喷出大量泡沫,起到灭火作用
D. 清晨,人们经常能看到阳光穿过茂密的树木枝叶所产生的美丽景象
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com