
【题目】某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。利用如图装置可验证同主族元素非金属性的变化规律

(1)仪器A的名称为_____,干燥管D的作用为__________。
(2)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液____(填现象),即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用____溶液吸收尾气。
(3)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液_______(填现象),即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰试验,应在两装置间添加装有______溶液的洗气瓶除去。
【答案】 分液漏斗 防止倒吸 溶液颜色变蓝 NaOH 变浑浊 饱和NaHCO3
【解析】(1)仪器A为分液漏斗;球形干燥管D能够防止倒吸,可以避免C中液体进入锥形瓶中;正确答案;锥形瓶;防止倒吸。
(2)浓盐酸和高锰酸钾反应生成氯气,氯气具有强氧化性,可与碘化钾反应生成碘,因淀粉遇碘变蓝色,则可观察到溶液变蓝,氯气有毒,不能排放到空气中,可与氢氧化钠溶液反应而被吸收,则可用氢氧化钠溶液进行尾气吸收;正确答案:溶液颜色变蓝;NaOH。
(3)因碳酸比硅酸强,二氧化碳可与硅酸钠反应生成硅酸沉淀,溶液变浑浊;氯化氢具有挥发性,干扰实验结果,需要将二氧化碳中的氯化氢除掉,根据氯化氢与碳酸氢钠反应,而二氧化碳不反应,可以在B和C之间增加装有饱和![]() 溶液的洗气瓶;正确答案:变浑浊 ;饱和NaHCO3。
溶液的洗气瓶;正确答案:变浑浊 ;饱和NaHCO3。


科目:高中化学 来源: 题型:
【题目】不能用有关胶体的观点解释的现象是( )
A. 在河流入海口处易形成三角洲B. 同一钢笔同时使用不同牌号的墨水可能发生堵塞
C. 在NaCl溶液中滴入KNO3溶液看不到沉淀D. 水泥厂、冶金厂常用静电除尘法除去工厂烟尘,减少对空气污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物在工业上有着广泛的应用.
完成下列填空:
(1)写出工业上以硫磺为原料生产硫酸的第一步反应方程式 .
(2)工业上用过硫酸钾(K2S2O8)测定钢铁中的锰含量,主要反应如下:
Mn2++S2O82﹣+H2O→ MnO4﹣+SO42﹣+H+
配平该反应方程式,氧化产物是 .
(3)用电解硫酸氢钾的方法制取过硫酸钾:HSO4﹣在(填:“阳极”或“阴极”)反应生成S2O82﹣ , 另一极生成氢气,生成0.1mol的S2O82﹣同时可收集到 g氢气.
(4)已知硫酸的第二级电离并不完全:HSO4﹣![]() H++SO42﹣(Ki=1.2×10﹣2);
H++SO42﹣(Ki=1.2×10﹣2);
在0.1mol/L的硫酸氢钾溶液中大约有30%的HSO4﹣电离,则该溶液中离子浓度由大到小排列第2位的离子是 , 第4位的离子是 . 往该溶液中加入硫酸氢钾固体并保持温度不变,则溶液中 ![]() (填:“增大”、“减小”或“不变”)
(填:“增大”、“减小”或“不变”)
(5)已知:HSO3﹣H++SO32﹣,K=1.02×10﹣7
NH4++H2ONH3H2O+H+ , K=5.65×10﹣10
往亚硫酸氢铵中加入一定量的氢氧化钡溶液,可能发生的反应离子方程式是(选填编号).
a.HSO3﹣+Ba2++OH﹣→BaSO3↓+H2O
b.NH4++2HSO3﹣+2Ba2++3OH﹣→2BaSO3↓+2H2O+NH3H2O
c.NH4++HSO3﹣+Ba2++2OH﹣→BaSO3↓+H2O+NH3H2O
d.2NH4++4HSO3﹣+3Ba2++6OH﹣→3BaSO3↓+4H2O+2NH3H2O+SO32﹣ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用组成物质的原子、离子或分子的一些特征性质,检验组成化学物质的元素,是研究物质组成的常用方法。下列叙述不正确的是( )
A.仅根据在火焰上燃烧产生的气味,不能确定毛线是“真羊毛”还是“人造羊毛”
B.用红外光谱仪确定物质中是否存在某些有机原子团
C.用元素分析仪确定物质中是否含有C H O N S Cl Br等元素
D.用原子吸收光谱确定物质中含有哪些金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学按如图所示的装置进行试验.A,B两种常见金属,它们的硫酸盐可溶于水,当K闭合时,在交换膜处SO ![]() 从右向左移动.下列说法错误的是( )
从右向左移动.下列说法错误的是( ) 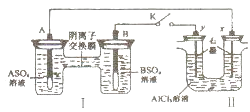
A.电解一段时间后,向Ⅱ装置通入适量的HCl气体可以恢复原来的浓度
B.反应初期,y电极周围出现白色沉淀
C.B电极质量增加
D.x电极产生气泡,且生成1mol气体的同时,有1molA参与反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池的工作原理为Pb+PbO2+4H++2SO ![]()
![]() 2PbSO4+2H2O.下图所示装置中,A为PbO2电极,B为Pb电极,E、F均为PbSO4电极,U形管中盛有足量硫酸溶液.先闭合S1足够长时间后断开S1 , 下列有关说法中不正确的是( )
2PbSO4+2H2O.下图所示装置中,A为PbO2电极,B为Pb电极,E、F均为PbSO4电极,U形管中盛有足量硫酸溶液.先闭合S1足够长时间后断开S1 , 下列有关说法中不正确的是( ) 
A.闭合S1时,左侧U形管为原电池,右侧U形管为电解池,F电极上生成氧气
B.若将两U形管中的溶液混合,混合液的质量分数仍为30%
C.若再单独闭合S2 , 电极
A.B的质量会逐渐增加,电极
B.F的质量会逐渐减小
C.若再单独闭合S2 ,
D.F电极上发生的反应与之前相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱工业是以电解饱和食盐水为原理的重要化工生产业.
(1)电解饱和食盐水的化学方程式是
(2)电解时阳极区溶液的pH用盐酸控制在2~3,用化学平衡移动原理解释盐酸的作用;
(3)用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO42﹣等杂质.某次除杂操作时,往粗盐水中先加入过量的(填化学式),至沉淀不再产生后,再加入过量的(填化学式)和NaOH,充分反应后将沉淀一并滤去.经检测发现滤液中仍含有一定量的SO42﹣ , 解释其原因[已知:Ksp(BaSO4)=1.1×10﹣10、Ksp(BaCO3)=5.1×10﹣9].
(4)食盐水中若含有NH4+ , 会在阳极产生难溶于水的NCl3 , 写出该电极反应式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向59.2g Fe2O3和FeO的混合物中加入某浓度的稀硝酸1.0L,固体物质完全反应,生成NO和Fe(NO3)3。在所得溶液中加入1.0mol/L的NaOH溶液2.8L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为85.6g。下列有关说法错误的是 ( )
A. Fe2O3和FeO的物质的量之比为1:6
B. 硝酸的物质的量浓度为3.0mol/L
C. 产生的NO在标准状况下的体积为4.48L
D. Fe2O3和FeO与硝酸反应后剩余0.2molHNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO45H2O是铜的重要化合物,有着广泛的应用.
(1)CuSO45H2O制取
完成下列填空:
a.向含铜粉的稀硫酸中滴加少量浓硝酸(可加热),铜粉溶解时可以观察到的实验现象: .
b.根据反应原理,硝酸与硫酸的理论配比(物质的量之比)为 .
c.步骤Ⅰ;步骤Ⅱ .
(2)胆矾中CuSO45H2O含量的测定
已知:CuSO4+2NaOH→Cu(OH)2↓+Na2SO4
a.实验方案如下,并将步骤④补全:
①将12.500g胆矾样品溶解,配成100mL溶液,取25mL于烧杯中;
②向溶液中加入100mL0.2500mol/L氢氧化钠溶液使Cu2+完全沉淀(不考虑其它副反应);
③过滤,多余的氢氧化钠溶液用0.5000mol/L盐酸滴定至终点,耗用10.00mL盐酸;
④
⑤数据处理.
b.在滴定中,眼睛应注视;滴定终点时,准确读数应该是滴定管上所对应的刻度.
c.就方案中数据进行处理,则样品CuSO45H2O中质量分数为 . 步骤③中沉淀未洗涤,导致结果(填偏大、偏小、无影响).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com