
【题目】铝及其化合物在生产生活中有着广泛的用途。
Ⅰ.高岭土化学组成为:Al2O3(25%~34%)、SiO2(40%~50%)、Fe2O3(0.5%~3.0%)以及少量杂质和水分。聚合氯化铝是一种新型、高效絮凝剂和净水剂,其单体是液态的碱式氯化铝[Al2(OH)nCl6-n]。用高岭土制备碱式氯化铝的工艺流程如下:

根据流程图回答下列问题:
(1)实验室配制4mol/L的盐酸1000mL需要用到的玻璃仪器有烧杯、玻璃棒、量筒、____________________等。
(2)加适量铝粉时所发生的离子反应方程式为________________________________。
Ⅱ.铝和镁的碱式碳酸盐(AlxMgy(OH)z(CO3)w·nH2O)是一种中和胃酸过多的常用药物,某化学兴趣小组通过以下实验探究该药物主要成分的化学式:
甲同学取该碱式盐9.03 g充分灼烧至恒重,测得剩余固体质量为5.13 g;
乙同学取相同质量的碱式盐使其溶于足量的盐酸中,收集到气体体积为336mL(已换算为标准状况);继续向溶液中加入足量的NaOH溶液得到5.22 g白色沉淀。试通过计算确定该碱式碳酸盐的化学式________。(写出计算过程,只有答案不给分)
【答案】1000mL容量瓶、胶头滴管 Al+Fe3+= Al3++Fe Al2Mg6(OH)16CO3·4H2O
【解析】
高岭土化学组成为:Al2O3(25%~34%)、SiO2(40%~50%)、Fe2O3(0.5%~3.0%)以及少量杂质和水分,由流程可知,高岭土在煅烧的过程中可除去杂质和水分,加足量盐酸得到沉淀SiO2,溶液中含Al3+、Fe3+,加适量铝粉,置换出铁,过滤去掉滤渣得氯化铝溶液,用碳酸钙调节溶液的pH,将溶液蒸发浓缩得碱式氯化铝,据此答题。
(1)实验室配制4mol/L的盐酸1000mL需要用到的仪器有烧杯、玻璃棒、量筒、1000mL容量瓶、胶头滴管等,所以除去烧杯、玻璃棒、量筒外,还需要的仪器为1000mL容量瓶、胶头滴管,故答案为:1000mL容量瓶、胶头滴管。
(2)加足量盐酸,溶液中含Al3+、Fe3+,加适量铝粉,置换出铁,反应的离子方程式为:Al+Fe3+=Al3++Fe,故答案为:Al+Fe3+=Al3++Fe。
(3)取该碱式盐9.03g溶于足量的盐酸中,收集到气体体积为336mL,该气体为CO2,336mL的CO2气体的物质的量为0.336L÷22.4L/mol=0.015mol,故n(CO32-)=n(CO2)=0.015mol,继续向溶液中加入足量的NaOH溶液得到5.22g白色沉淀,该沉淀为Mg(OH)2,故n[Mg(OH)2]=5.22g÷58g/mol=0.09mol,则n(Mg2+)=n[Mg(OH)2]=0.09mol,取该碱式盐9.03g充分灼烧至恒重,测得剩余固体质量为5.13g,该固体为Al2O3和MgO,Al2O3的物质的量为(5.13g-0.09mol×40g/mol)÷102g/mol=0.015mol,则n(Al3+)=2n(Al2O3)=0.03mol,利用电荷守恒2n(Mg2+)+3n(Al3+)=n(OH-)+2n(CO32-),故n(OH-)=0.03mol×3+0.09mol×2-0.015mol×2=0.24mol,故:m(CO32-)=0.015mol×60g·mol-1=0.9g,m(OH-)=0.24mol×17g·mol-1=4.08g,m(Mg2+)=0.09mol×24g·mol-1=2.16g,m(Al3+)=0.03mol×27g·mol-1=0.81g,所以m(H2O)=9.03g-0.9g-4.08g-2.16g-0.81g=1.08g,故n(H2O)=1.08g÷18g/mol=0.06mol,则n(Al3+):n(Mg2+):n(OH-):n(CO32-):n(H2O)=0.03:0.09:0.24:0.015:0.06=2:6:16:1:4,该碱式碳酸盐的化学式为Al2Mg6(OH)16CO3·4H2O,故答案为:Al2Mg6(OH)16CO3·4H2O。


科目:高中化学 来源: 题型:
【题目】利用“Na—CO2”电池可将 CO2 变废为宝。我国科研人员研制出的可充电“Na—CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,放电时总反应的化学方程式为 4Na+3CO2=2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示,下列说法中不正确的是
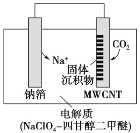
A.电流流向为 MWCNT→导线→钠箔
B.放电时,正极的电极反应式为 3CO2+4Na++4e-=2Na2 CO3+C
C.选用高氯酸钠—四甘醇二甲醚作电解液的优点是导电性好,不与金属钠反应,难挥发
D.原两电极质量相等,若生成的Na2CO3 和C 全部沉积在电极表面,当转移 0.2 mol e-时,两极的质量差为 11.2 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BE是现代有机化工重要的单体之一,工业上采取乙苯催化脱氢制苯乙烯反应制备:
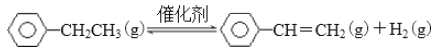
(1)已知:
化学键 | C-H | C-C | C=C | H-H |
键能/ | 412 | 348 | 612 | 436 |
计算上述反应的![]() _______
_______![]() 。该反应能够发生的原因是______
。该反应能够发生的原因是______
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应。已知乙苯的平衡转化率为![]() ,则在该温度下反应的平衡常数K=_______(用a等符号表示)。
,则在该温度下反应的平衡常数K=_______(用a等符号表示)。
(3)工业上,通常在乙苯蒸气中掺混水蒸气,控制反应温度600℃,并保持体系总压为常压的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了![]() 以外的产物中苯乙烯的物质的量分数)示意图如图所示:
以外的产物中苯乙烯的物质的量分数)示意图如图所示:
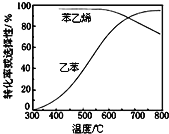
a.掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实__________。
b.控制反应温度为![]() 的理由是___________
的理由是___________
(4)在逆过程苯乙烯加氢制乙苯的操作中,如果氢气中混有![]() 和
和![]() 等杂质,会引起催化剂中毒,因此必须除去。在常温下,可以用银氨溶液来检测微量的
等杂质,会引起催化剂中毒,因此必须除去。在常温下,可以用银氨溶液来检测微量的![]() ,其原理与银镜反应相似,有银析出,写出银氨溶液与
,其原理与银镜反应相似,有银析出,写出银氨溶液与![]() 反应的离子方程式________________。
反应的离子方程式________________。
(5)苯乙烯废气在工业上常用电催化氧化处理,原理如图所示:
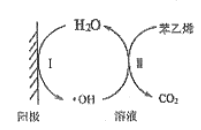
写出阳极电极反应式I为______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下将1 mol N2和3 mol H2置于密闭容器中发生反应N2+3H2![]() 2NH3(正反应是放热反应)。下列关于该反应的说法正确的是
2NH3(正反应是放热反应)。下列关于该反应的说法正确的是
A. 降低温度可以加快反应速率
B. 达到化学反应限度时,生成2mol NH3
C. 向容器中再加入N2可以加快反应速率
D. 1mol N2 和3mol H2的总能量低于2mol NH3的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据实验操作和现象所得出的结论不正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向NaHS溶液中滴入酚酞 | 溶液变红色 | HS-水解程度大于电离程度 |
B | 向浓度均为0.1mol/L的MgCl2、CuCl2混合溶液中逐滴加入氨水 | 出现蓝色沉淀 | Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
C | 向Na2CO3溶液中加入浓盐酸,将产生的气体通入硅酸钠溶液中 | 产生白色浑浊 | 酸性:盐酸>碳酸>硅酸 |
D | 向盛有KI3溶液的两试管中分别加入淀粉溶液和AgNO3溶液 | 前者溶液变蓝色,后者有黄色沉淀 | KI3溶液中存在I |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种无机物之间转化关系如下图(反应条件省略。部分产物省略)。下列推断不正确的是
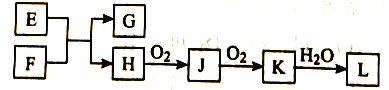
A. 若L为强碱,则E可能为NaCl溶液、F为钾
B. 若L为强酸,则E可能为NaHS、F为HNO3
C. 若L为弱酸,则E可能为Mg、F为CO2
D. 若L为强酸,则E可能为NH4Cl、F为Ca(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图是化学课外活动小组设计的用化学电源使LED灯发光的装置示意图。下列有关该装置的说法正确的是( )

A. 铜片为负极,其附近的溶液变蓝,溶液中有Cu2+产生
B. 如果将锌片换成铁片,电路中的电流方向将改变
C. 其能量转化的形式主要是“化学能→电能→光能”
D. 如果将稀硫酸换成柠檬汁,LED灯将不会发光
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. ![]() 互为同系物
互为同系物
B. ![]() 的系统命名是2-甲基-1-丙醇
的系统命名是2-甲基-1-丙醇
C. 相同压强下的沸点:乙醇>乙二醇>丙烷
D. 室温下,在水中的溶解度:甘油>苯酚> 1-氯丁烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某NaCl溶液样品中含有Na2SO4、CaCl2杂质(该溶液用X表示),除去杂质的实验方案如图所示。

请回答:
(1)溶液B中存在的阳离子为____________,阴离子为___________。
(2)固体C中所含物质的化学式为__________。
(3)溶液D中加入适量盐酸后,大量减少的微粒为__________。
(4)①和②不能调换顺序的理由为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com