
【题目】一定条件下将1 mol N2和3 mol H2置于密闭容器中发生反应N2+3H2![]() 2NH3(正反应是放热反应)。下列关于该反应的说法正确的是
2NH3(正反应是放热反应)。下列关于该反应的说法正确的是
A. 降低温度可以加快反应速率
B. 达到化学反应限度时,生成2mol NH3
C. 向容器中再加入N2可以加快反应速率
D. 1mol N2 和3mol H2的总能量低于2mol NH3的总能量
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R、Q、M是六种短周期元素,原子序数依次增大。X是原子半径最小的元素,Y的气态氢化物能使湿润的红色石蕊试纸变蓝,Z为地壳中含量最多的元素,R与X同主族;Y、R、Q最外层电子数之和为8,M的单质为黄绿色有害气体。请回答下列问题:
(1)R在元素周期表中的位置为__________________。
(2)Z、Q、M简单离子半径由大到小的顺序为(写元素离子符号)_____________________。
(3)YX4M的电子式为___________________,Q3Y2与水可剧烈反应,产生沉淀与气体,反应的化学方程式为___________________________________。
(4)X、Z两元素形成的原子个数比为1∶1的化合物的结构式____________。
(5)M的单质与R的最高价氧化物对应的水化物反应的离子方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制500mL 0.100 mol·Lˉ1的NaCl溶液,部分实验操作示意图如下:
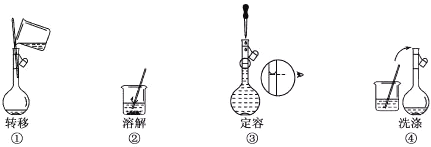
下列说法正确的是
A. 实验中需用的仪器有:天平、250mL容量瓶、烧杯、玻璃棒、胶头滴管等
B. 上述实验操作步骤的正确顺序为①②④③
C. 容量瓶需要用自来水、蒸馏水洗涤,干燥后才可用
D. 定容时,仰视容量瓶的刻度线,使配得的NaCl溶液浓度偏低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将aLNH3完全溶于水得到VmL氨水,溶液的密度为ρg/cm3,溶质的质量分数为ω,溶质的物质的量浓度为cmol/L。下列叙述中正确的是()
①![]()
② ![]()
③ 若上述溶液中再加入VmL水后,所得溶质的质量分数大于0.5ω
④ 若上述溶液中再加入0.5mL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:
c(NH4+)>c(Cl-)>c(OH-)>c(H+)
A.①④ B.②③ C.②④ D.①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 0.1 molL﹣1的KI溶液:Na+、Ag+、NO3﹣、SO42﹣
B. 使甲基橙变红色的溶液:NH4+、Cu2+、ClO﹣、Cl﹣
C. c(OH﹣)=0.1mol/L的溶液:Na+、K+、CO32﹣、ClO﹣
D. 0.1 molL﹣1的KMnO4溶液:Na+、K+、Cl﹣、SO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用工业废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3的流程如下:

下列说法错误的是( )
A. 向大气中排放SO2可能导致酸雨发生
B. 中和器中发生反应的离子方程式为HSO3-+OH-= SO32-+H2O
C. 检验Na2SO3成品中是否含Na2SO4,可选用稀盐酸和Ba(NO3)2溶液
D. 进入离心机的分散系是悬浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝及其化合物在生产生活中有着广泛的用途。
Ⅰ.高岭土化学组成为:Al2O3(25%~34%)、SiO2(40%~50%)、Fe2O3(0.5%~3.0%)以及少量杂质和水分。聚合氯化铝是一种新型、高效絮凝剂和净水剂,其单体是液态的碱式氯化铝[Al2(OH)nCl6-n]。用高岭土制备碱式氯化铝的工艺流程如下:

根据流程图回答下列问题:
(1)实验室配制4mol/L的盐酸1000mL需要用到的玻璃仪器有烧杯、玻璃棒、量筒、____________________等。
(2)加适量铝粉时所发生的离子反应方程式为________________________________。
Ⅱ.铝和镁的碱式碳酸盐(AlxMgy(OH)z(CO3)w·nH2O)是一种中和胃酸过多的常用药物,某化学兴趣小组通过以下实验探究该药物主要成分的化学式:
甲同学取该碱式盐9.03 g充分灼烧至恒重,测得剩余固体质量为5.13 g;
乙同学取相同质量的碱式盐使其溶于足量的盐酸中,收集到气体体积为336mL(已换算为标准状况);继续向溶液中加入足量的NaOH溶液得到5.22 g白色沉淀。试通过计算确定该碱式碳酸盐的化学式________。(写出计算过程,只有答案不给分)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某水溶液中可能含有Na+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、SO42-离子中的若干种。某同学取200 mL该溶液分成两等份依次进行如下实验:①向第一份溶液中加过量的NaOH溶液后加热,充分反应后生成0.02 mol气体(标况),无沉淀产生,同时得到溶液甲;②向溶液甲中通入过量的CO2,充分反应生成白色沉淀,沉淀经过滤、洗涤、灼烧至恒重得到1.02 g固体;③向第二份溶液中加入足量的BaCl2溶液,充分反应生成白色沉淀,沉淀用盐酸充分洗涤、干燥,得到11.65 g固体。据此,该同学得到的结论正确的是( )
A. 实验①中产生的气体为氨气,并可得原溶液中c(NH4+)=0.02 mol/L
B. 实验③中的沉淀里一定有BaSO4,可能有Mg(OH)2
C. 若要确定原溶液中是否含有Cl-,无需另外再设计实验验证
D. 原溶液中一定含有Na+,且c(Na+)≥0.2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种新型,高效、多功能绿色水处理剂,可通过KClO溶液与Fe(NO3)3溶液的反应制备。
已知:①KClO在较高温度下发生歧化反应生成KClO3
②K2FeO4具有下列性质:可溶于水、微溶于浓KOH溶液;在强碱性溶液中比较稳定;在Fe3+催化作用下发生分解,在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2,如图所示是实验室模拟工业制备KClO溶液装置。

(1)B装置的作用为______________________;
(2)反应时需将C装置置于冷水浴中,其原因为__________________;
(3)制备K2FeO4时,不能将碱性的KClO溶液滴加到Fe(NO3)3饱和溶液中,其原因是________,制备K2FeO4的离子方程式_________________;
(4)工业上常用废铁屑为原料制备Fe(NO3)3溶液,溶液中可能含有Fe2+,检验Fe2+所需试剂名称________,其反应原理为______________________(用离子方程式表示);
(5)向反应后的三颈瓶中加入饱和KOH溶液,析出K2FeO4固体,过滤、洗涤、干燥。洗涤操作所用最佳试剂为______________________;
A.水 B.无水乙醇 C.稀KOH溶液
(6)工业上用“间接碘量法”测定高铁酸钾的纯度:用碱性KI溶液溶解1.00g K2FeO4样品,调节pH使高铁酸根全部被还原成亚铁离子,再调节pH为3~4,用1.0mol/L的Na2S2O3标准溶液作为滴定剂进行滴定(2Na2S2O3+I2=Na2S4O6+2NaI),淀粉作指示剂,装有Na2S2O3标准溶液的滴定管起始和终点读数如如图所示:

①消耗Na2S2O3标准溶液的体积为____________mL。
②原样品中高铁酸钾的质量分数为_________________。[M(K2FeO4)=198g/mol]
③若在配制Na2S2O3标准溶液的过程中定容时俯视刻度线,则导致所测高铁酸钾的质量分数____________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com