
【题目】某水溶液中可能含有Na+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、SO42-离子中的若干种。某同学取200 mL该溶液分成两等份依次进行如下实验:①向第一份溶液中加过量的NaOH溶液后加热,充分反应后生成0.02 mol气体(标况),无沉淀产生,同时得到溶液甲;②向溶液甲中通入过量的CO2,充分反应生成白色沉淀,沉淀经过滤、洗涤、灼烧至恒重得到1.02 g固体;③向第二份溶液中加入足量的BaCl2溶液,充分反应生成白色沉淀,沉淀用盐酸充分洗涤、干燥,得到11.65 g固体。据此,该同学得到的结论正确的是( )
A. 实验①中产生的气体为氨气,并可得原溶液中c(NH4+)=0.02 mol/L
B. 实验③中的沉淀里一定有BaSO4,可能有Mg(OH)2
C. 若要确定原溶液中是否含有Cl-,无需另外再设计实验验证
D. 原溶液中一定含有Na+,且c(Na+)≥0.2 mol/L
【答案】D
【解析】
①第一份加过量NaOH溶液后加热,收集到0.02mol气体,该气体为氨气,溶液中一定含有NH4+,物质的量为0.02mol,其浓度为:c(NH4+)=![]()
无沉淀生成,则一定不含有Fe3+、Mg2+;
②向甲溶液中通入过量CO2,生成白色沉淀,该白色沉淀即为Al(OH)3,则原溶液中一定有Al3+,由于Al3+与CO32-不能大量共存,所以一定不含有CO32-,Al3+和过量的NaOH反应生成NaAlO2溶液,向溶液中通入过量CO2,生成白色沉淀,即为氢氧化铝,氢氧化铝沉淀经过滤、洗涤、灼烧后,得到1.02g固体即为氧化铝,根据铝元素守恒,得到铝离子的物质的量是n(Al3+)=2×![]() =0.02mol;c(Al3+)=
=0.02mol;c(Al3+)=![]()
③第二份溶液中加足量BaCl2溶液后,生成白色沉淀,则一定含有SO42-离子,无Ba2+。沉淀经足量盐酸洗涤、干燥后,得到11.65g固体即BaSO4的质量是11.65g,物质的量为:n(BaSO4)=11.65g÷233g/mol=0.05mol,根据S元素守恒,可知SO42-的物质的量是0.05mol,c(SO42-)=0.05mol÷0.1L=0.5mol/L。
综上可知,一定含有的离子是:NH4+、Al3+、SO42-,其浓度分别是:0.2mol/L;0.2mol/L;0.5mol/L,一定不含Fe3+、Mg2+、Ba2+、SO42,不能确定是否存在氯离子。
A.根据以上分析可知,c(NH4+)=0.2 mol/L,A错误;
B.根据以上分析可知,③中的白色沉淀中一定有BaSO4,因溶液不存在镁离子,则没有生成氢氧化镁,B错误;
C.由以上分析可知,不能确定氯离子是否存在,C错误;
D.任何溶液中都存在电荷守恒,NH4+、Al3+、SO42-,其浓度分别是:0.2mol/L;0.2mol/L;0.5mol/L,可知NH4+、Al3+的正电荷总量小于SO42-负电荷总量,依据溶液中阳离子带的正电荷总数等于阴离子带的负电荷总数,则一定有Na+存在,若无氯离子存在,则0.2×1+0.2×3+c(Na+)×1=0.5×2,解得c(Na+)=0.2mol/L,若含有氯离子,则c(Na+)>0.2mol/L,D正确;
故合理选项是D。


科目:高中化学 来源: 题型:
【题目】工业中很多重要的化工原料都来源于石油化工,如图中的苯、丙烯、有机物 A 等,其中 A 的产量可以用来衡量一个国家的石油化工发展水平。请回答下列问题:

(1)A 的结构简式为_________,丙烯酸中官能团的名称为_________。
(2)写出下列反应的反应类型①_________,②_________。
(3)下列说法正确的是_________。
A.硝基苯中混有浓 HNO3 和 H2SO4,将其倒入到 NaOH 溶液中,静置,分液
B.除去乙酸乙酯中的乙酸,加 NaOH 溶液、分液
C.聚丙烯酸能够使酸性高锰酸钾溶液褪色
D.有机物 C 与丙烯酸属于同系物
(4)写出下列反应方程式:
丙烯酸生成聚丙烯酸:_________。
丙烯酸 + B →丙烯酸乙酯_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下将1 mol N2和3 mol H2置于密闭容器中发生反应N2+3H2![]() 2NH3(正反应是放热反应)。下列关于该反应的说法正确的是
2NH3(正反应是放热反应)。下列关于该反应的说法正确的是
A. 降低温度可以加快反应速率
B. 达到化学反应限度时,生成2mol NH3
C. 向容器中再加入N2可以加快反应速率
D. 1mol N2 和3mol H2的总能量低于2mol NH3的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种无机物之间转化关系如下图(反应条件省略。部分产物省略)。下列推断不正确的是
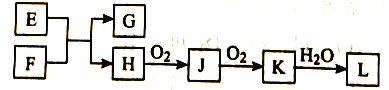
A. 若L为强碱,则E可能为NaCl溶液、F为钾
B. 若L为强酸,则E可能为NaHS、F为HNO3
C. 若L为弱酸,则E可能为Mg、F为CO2
D. 若L为强酸,则E可能为NH4Cl、F为Ca(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图是化学课外活动小组设计的用化学电源使LED灯发光的装置示意图。下列有关该装置的说法正确的是( )

A. 铜片为负极,其附近的溶液变蓝,溶液中有Cu2+产生
B. 如果将锌片换成铁片,电路中的电流方向将改变
C. 其能量转化的形式主要是“化学能→电能→光能”
D. 如果将稀硫酸换成柠檬汁,LED灯将不会发光
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从有机反应R-H+Cl2R-Cl(液)+HCl(气)制取副产品盐酸的设想已成为现实。高一兴趣小组设计了如图模拟装置图,请回答下列问题:

(1)写出实验室制Cl2 的离子方程式_________。
(2)装置B 中盛放的溶液是_________;作用是_________。
(3)装置C有三种功能:①_________②_________③观察气泡的产生情况,便于控制两种气体的配比。
(4)玻璃管E中放在石棉碎块上的碘化钾的作用是________;导管末端“肚形”装置的作用是________。
(5)从F 中分离出盐酸的最佳方法是________;该套实验装置还存在的缺陷是________。
(6)内江六中高一另一兴趣小组设计Cl2与NH3反应来验证非金属元素氯的氧化性强于和氮,请写出Cl2与足量NH3反应的化学方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. ![]() 互为同系物
互为同系物
B. ![]() 的系统命名是2-甲基-1-丙醇
的系统命名是2-甲基-1-丙醇
C. 相同压强下的沸点:乙醇>乙二醇>丙烷
D. 室温下,在水中的溶解度:甘油>苯酚> 1-氯丁烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】解释下列事实的方程式不正确的是
A. 次氯酸钙溶液中通入过量二氧化硫:Ca2+ + 2ClO-+ H2O + SO2=CaSO3↓+ 2HClO
B. 硫酸型酸雨放置一段时间溶液的pH下降:2H2SO3+O2=2H2SO4
C. 纯碱液可以清洗油污的原因:CO32+H2O![]() HCO3+OH
HCO3+OH
D. 向K2Cr2O7溶液中加入少量NaOH浓溶液,溶液由橙色变为黄色:Cr2O72—+H2O![]() 2CrO42—+2H+
2CrO42—+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废镀锌铁皮制备磁性Fe3O4胶体粒子及副产物ZnSO4晶体的实验流程如下:

已知:Zn及其化合物的性质与Al及其化合物的性质相似。
(1)用NaOH溶液处理废镀锌铁皮除溶解锌外,另一个作用是_______________。为缩短用NaOH溶液处理废镀锌铁皮的时间,可采取的措施是_____________(答两条)。
(2)加入适量H2O2溶液的主要作用是______________。溶液B中n(Fe2+):n(Fe3+)=______。
(3)在由溶液B制得Fe3O4胶体粒子的过程中,须缓慢滴加稀NaOH溶液并持续通入N2,持续通入N2的原因是_____________________。
(4)请补充完整下列由溶液A获得副产品ZnSO4晶体的实验步骤:
①向溶液A中通入CO2气体,得到Zn (OH)2沉淀;
②______________、洗涤得到沉淀;
③______________;
④将溶液加热浓缩、冷却结晶、过滤、洗涤、干燥即可得到产品。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com