
【题目】几种无机物之间转化关系如下图(反应条件省略。部分产物省略)。下列推断不正确的是
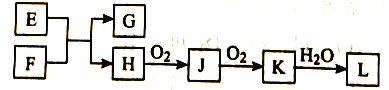
A. 若L为强碱,则E可能为NaCl溶液、F为钾
B. 若L为强酸,则E可能为NaHS、F为HNO3
C. 若L为弱酸,则E可能为Mg、F为CO2
D. 若L为强酸,则E可能为NH4Cl、F为Ca(OH)2
【答案】A
【解析】
A、E为NaCl溶液、F为钾,G为KOH,H为H2,H2与O2生成H2O,H2O与O2不反应,故A错误;B、若L为强酸,则E可能为NaHS、F为HNO3,NaHS与HNO3生成Na2SO4和NO,NO与O2反应生成NO2,NO2与水反应生成HNO3,L是HNO3是强酸,故B正确;C、若L为弱酸,则E可能为Mg、F为CO2,Mg与CO2 反应生成MgO和C,C与O2反应生成CO,CO再与O2反应生成CO2,CO2溶于水生成H2CO3,L为H2CO3,是弱酸,故C正确; D.若L为强酸,则E可能为NH4Cl、F为Ca(OH)2,NH4Cl与Ca(OH)2反应生成CaCl2 和NH3,NH3与O2反应生成NO,NO与O2反应生成NO2,NO2溶于水生成HNO3,L是HNO3是强酸,故D正确;故选A。


科目:高中化学 来源: 题型:
【题目】为了探究原电池和电解池的工作原理,某研究性学习小组分别用下图所示的装置进行实验。据图回答问题。

I.用图甲所示装置进行第一组实验时:
(1)在保证电极反应不变的情况下,不能替代Cu作电极的是_____ (填字母)。
A石墨 B. 镁 C.银 D.铂
(2)实验过程中,SO42-____(填“从左向右”“从右向左”或“不”)移动;滤纸上能观察到的现象是________________。
II.该小组同学用图乙所示装置进行第二组实验时发现,两极均有气体产生,且Y极处溶液逐渐变成紫红色;停止实验观察到铁电极明显变细,电解液仍然澄清。查阅资料知,高铁酸根(FeO42-)在溶液中呈紫红色。请根据实验现象及所查信息,回答下列问题:
(3)电解过程中,X极处溶液的OH-浓度____(填“增大”“减小”或“不变)。
(4)电解过程中,Y极发生的电极反应为___________________,_________________。
(5)电解进行一段时间后,若在Y电板(铁电极)质量减小2.8g,在Y极收集到气体为1.68 L 则X极收集到气体__________L(均己折算为标准状况时气体体积)。
(6)K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电池反应总反应式为2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,该电池正极发生的电极反应式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将aLNH3完全溶于水得到VmL氨水,溶液的密度为ρg/cm3,溶质的质量分数为ω,溶质的物质的量浓度为cmol/L。下列叙述中正确的是()
①![]()
② ![]()
③ 若上述溶液中再加入VmL水后,所得溶质的质量分数大于0.5ω
④ 若上述溶液中再加入0.5mL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:
c(NH4+)>c(Cl-)>c(OH-)>c(H+)
A.①④ B.②③ C.②④ D.①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用工业废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3的流程如下:

下列说法错误的是( )
A. 向大气中排放SO2可能导致酸雨发生
B. 中和器中发生反应的离子方程式为HSO3-+OH-= SO32-+H2O
C. 检验Na2SO3成品中是否含Na2SO4,可选用稀盐酸和Ba(NO3)2溶液
D. 进入离心机的分散系是悬浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝及其化合物在生产生活中有着广泛的用途。
Ⅰ.高岭土化学组成为:Al2O3(25%~34%)、SiO2(40%~50%)、Fe2O3(0.5%~3.0%)以及少量杂质和水分。聚合氯化铝是一种新型、高效絮凝剂和净水剂,其单体是液态的碱式氯化铝[Al2(OH)nCl6-n]。用高岭土制备碱式氯化铝的工艺流程如下:

根据流程图回答下列问题:
(1)实验室配制4mol/L的盐酸1000mL需要用到的玻璃仪器有烧杯、玻璃棒、量筒、____________________等。
(2)加适量铝粉时所发生的离子反应方程式为________________________________。
Ⅱ.铝和镁的碱式碳酸盐(AlxMgy(OH)z(CO3)w·nH2O)是一种中和胃酸过多的常用药物,某化学兴趣小组通过以下实验探究该药物主要成分的化学式:
甲同学取该碱式盐9.03 g充分灼烧至恒重,测得剩余固体质量为5.13 g;
乙同学取相同质量的碱式盐使其溶于足量的盐酸中,收集到气体体积为336mL(已换算为标准状况);继续向溶液中加入足量的NaOH溶液得到5.22 g白色沉淀。试通过计算确定该碱式碳酸盐的化学式________。(写出计算过程,只有答案不给分)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuI是有机合成的一种催化剂,受热易氧化。实验室可通过向CuSO4与NaI的混合溶液中通入SO2制备CuI(2CuSO4+2NaI+SO2+2H2O![]() 2CuI↓+2H2SO4+Na2SO4)。下列实验原理和装置不能达到实验目的的是( )
2CuI↓+2H2SO4+Na2SO4)。下列实验原理和装置不能达到实验目的的是( )
A. 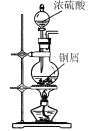 制备SO2
制备SO2
B. 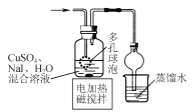 制备CuI并制备少量含SO2的溶液
制备CuI并制备少量含SO2的溶液
C. 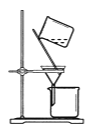 将CuI与母液分离并用装置制得的含SO2的溶液洗涤沉淀
将CuI与母液分离并用装置制得的含SO2的溶液洗涤沉淀
D. 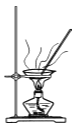 加热干燥湿的CuI固体
加热干燥湿的CuI固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某水溶液中可能含有Na+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、SO42-离子中的若干种。某同学取200 mL该溶液分成两等份依次进行如下实验:①向第一份溶液中加过量的NaOH溶液后加热,充分反应后生成0.02 mol气体(标况),无沉淀产生,同时得到溶液甲;②向溶液甲中通入过量的CO2,充分反应生成白色沉淀,沉淀经过滤、洗涤、灼烧至恒重得到1.02 g固体;③向第二份溶液中加入足量的BaCl2溶液,充分反应生成白色沉淀,沉淀用盐酸充分洗涤、干燥,得到11.65 g固体。据此,该同学得到的结论正确的是( )
A. 实验①中产生的气体为氨气,并可得原溶液中c(NH4+)=0.02 mol/L
B. 实验③中的沉淀里一定有BaSO4,可能有Mg(OH)2
C. 若要确定原溶液中是否含有Cl-,无需另外再设计实验验证
D. 原溶液中一定含有Na+,且c(Na+)≥0.2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】安全存储与运输有机化合物,避免造成污染是重要的社会责任。C-9芳烃主要指催化重整和裂解制乙烯副产物中的含九个碳原子的芳香烃,沸点在153℃左右。下列说法不正确的是
A. 得到C-9芳烃的过程中发生了化学变化
B. ![]() 是C-9芳烃的组分之一
是C-9芳烃的组分之一
C. C-9芳烃常温下为液态,密度比水小
D. 运输C-9芳烃的车辆所贴的危险化学品标志是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用如图所示的装置及药品制取氨气。

(1)A中发生反应的化学方程式为__________________。
(2)B中盛放的试剂名称为___________________。
(3)C为用集气瓶收集氨气的装置,请绘出完装置图___________________。
(4)证明氨气已收集满的操作和现象为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com