
【题目】X、Y、Z、R、Q、M是六种短周期元素,原子序数依次增大。X是原子半径最小的元素,Y的气态氢化物能使湿润的红色石蕊试纸变蓝,Z为地壳中含量最多的元素,R与X同主族;Y、R、Q最外层电子数之和为8,M的单质为黄绿色有害气体。请回答下列问题:
(1)R在元素周期表中的位置为__________________。
(2)Z、Q、M简单离子半径由大到小的顺序为(写元素离子符号)_____________________。
(3)YX4M的电子式为___________________,Q3Y2与水可剧烈反应,产生沉淀与气体,反应的化学方程式为___________________________________。
(4)X、Z两元素形成的原子个数比为1∶1的化合物的结构式____________。
(5)M的单质与R的最高价氧化物对应的水化物反应的离子方程式为_________________。
【答案】第三周期ⅠA族 Cl->O2->Mg2+ ![]() Mg3N2+6H2O=3Mg(OH)2+2NH3↑ H-O-O-H Cl2+2OH-=ClO-+Cl-+H2O
Mg3N2+6H2O=3Mg(OH)2+2NH3↑ H-O-O-H Cl2+2OH-=ClO-+Cl-+H2O
【解析】
X、Y、Z、R、Q、M是六种短周期元素,原子序数依次增大.X是原子半径最小的元素,故X为H元素;Y的气态氢化物能使湿润的红色石蕊试纸变蓝,故为氨气,则Y为N元素;Z为地壳中含量最多的元素,故为O元素;R与X同主族,且原子序数大于8,故R为Na元素;Y、R、Q最外层电子数之和为8,故Q的最外层有2个电子,且原子序数比11大,故为Mg元素;M的单质黄绿色有害气体,故为Cl元素.
(1)R为Na元素,其原子序数为11,位于周期表中第三周期第IA族,故答案为:第三周期第IA族;
(2)Z、Q、M简单离子分别为O2-、Mg2+、Cl-,而微粒的电子层数越多,则半径越大,故Cl-的半径最大;当电子层数相同时,核电荷数越多,则半径越小,故Mg2+的半径最小,故简单离子半径由大到小的顺序为Cl->O2->Mg2+,故答案为:Cl->O2->Mg2+;
(3)YX4M为NH4Cl,为离子化合物,其电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(4)Q3Y2为Mg2N3,在水溶液中发生双水解生成氢氧化镁和氨气,反应的化学方程式为:Mg3N2+6H2O=3Mg(OH)2+2NH3↑,故答案为:Mg3N2+6H2O=3Mg(OH)2+2NH3↑;
(5) X、Z两元素形成的原子个数比为1∶1的化合物为H2O2,其结构式为H-O-O-H,故答案为:H-O-O-H;
(6)M的单质即为氯气,与R的最高价氧化物对应的水化物即为NaOH反应,生成氯化钠、次氯酸钠和水,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O。


科目:高中化学 来源: 题型:
【题目】在一密闭容器中有HCHO、H2和O2混合气体共10 g,放入足量Na2O2用电火花引燃,使其完全反应,Na2O2增重4 g,则原混合气体中O2的质量分数是
A.40% B.33.3% C.60% D.36%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研人员提出HCHO(甲醛)与O2在羟基磷灰石(HAP)表面催化生成H2O的历程,该历程示意图如下(图中只画出了 HAP的部分结构):
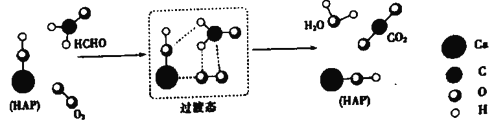
下列说法不正确的是
A. HAP能提高HCHO与O2的反应速率
B. HCHO在反应过程中,有C-H键发生断裂
C. 根据图示信息,CO2分子中的氧原子全部来自O2
D. 该反应可表示为:HCHO+O2![]() CO2+H2O
CO2+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在恒容密闭容器中充入一定量的H2和CO,在催化剂作用下发生如下反应:CO(g)+2H2(g)![]() CH3OH(g)△H<0。反应达到平衡时,CH3OH体积分数与
CH3OH(g)△H<0。反应达到平衡时,CH3OH体积分数与![]() 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是

A. 反应达平衡时,升高体系温度,CO转化率升高
B. 反应达平衡时,再充入一定量Ar,平衡右移,平衡常数不变
C. 容器内混合气体的密度不再变化说明该反应达到平衡状态
D. ![]() =2.5时达到平衡状态,CH3OH的体积分数可能是图中的F点
=2.5时达到平衡状态,CH3OH的体积分数可能是图中的F点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气中汽油含量的测量仪,其工作原理如图所示(用强酸性溶液作电解质溶液)。下列说法中不正确的是
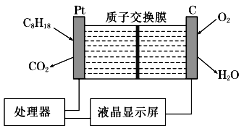
A. 石墨电极作正极,发生还原反应
B. 铂电极的电极反应式为C8H18+16H2O-50e-=8CO2↑+50 H+
C. H+由质子交换膜左侧向右侧迁移
D. 每消耗5.6 L O2,电路中通过1 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应对应的离子方程式书写正确的是
A. 饱和碳酸钠溶液中通入足量的二氧化碳:2Na++CO32-+CO2+H2O=2NaHCO3↓
B. KIO3与KI在酸性溶液中反应:5I-+IO3-+3H2O═3I2+6OH-
C. 向Al2(SO4)3溶液中加入过量的氨水:Al3++4NH3·H2O═AlO2-+4NH4++2H2O
D. 饱和石灰水与醋酸溶液混合:Ca(OH)2+2CH3COOH=Ca2++2CH3COO-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用“Na—CO2”电池可将 CO2 变废为宝。我国科研人员研制出的可充电“Na—CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,放电时总反应的化学方程式为 4Na+3CO2=2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示,下列说法中不正确的是
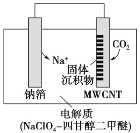
A.电流流向为 MWCNT→导线→钠箔
B.放电时,正极的电极反应式为 3CO2+4Na++4e-=2Na2 CO3+C
C.选用高氯酸钠—四甘醇二甲醚作电解液的优点是导电性好,不与金属钠反应,难挥发
D.原两电极质量相等,若生成的Na2CO3 和C 全部沉积在电极表面,当转移 0.2 mol e-时,两极的质量差为 11.2 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业中很多重要的化工原料都来源于石油化工,如图中的苯、丙烯、有机物 A 等,其中 A 的产量可以用来衡量一个国家的石油化工发展水平。请回答下列问题:

(1)A 的结构简式为_________,丙烯酸中官能团的名称为_________。
(2)写出下列反应的反应类型①_________,②_________。
(3)下列说法正确的是_________。
A.硝基苯中混有浓 HNO3 和 H2SO4,将其倒入到 NaOH 溶液中,静置,分液
B.除去乙酸乙酯中的乙酸,加 NaOH 溶液、分液
C.聚丙烯酸能够使酸性高锰酸钾溶液褪色
D.有机物 C 与丙烯酸属于同系物
(4)写出下列反应方程式:
丙烯酸生成聚丙烯酸:_________。
丙烯酸 + B →丙烯酸乙酯_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下将1 mol N2和3 mol H2置于密闭容器中发生反应N2+3H2![]() 2NH3(正反应是放热反应)。下列关于该反应的说法正确的是
2NH3(正反应是放热反应)。下列关于该反应的说法正确的是
A. 降低温度可以加快反应速率
B. 达到化学反应限度时,生成2mol NH3
C. 向容器中再加入N2可以加快反应速率
D. 1mol N2 和3mol H2的总能量低于2mol NH3的总能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com