
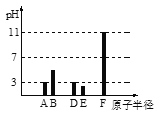
【题目】已知A、B、D、E、F均为短周期元素(原子序数B<A<F<E<D)。25℃时,其最高价氧化物的水化物(设浓度均为0.001mol/L)溶液的pH和原子半径的关系如图所示。下列说法中正确的是
A. A和F的简单离子半径大小顺序:A < F
B. 上述五种元素中有两种元素是金属元素
C. D的最高价氧化物水化物的化学式为HDO3
D. D、E的气态氢化物的稳定性:D > E
【答案】D
【解析】
由图可知,原子半径F>E>D>B>A, F的半径最大且其0.001mol/L最高价氧化物对应的水化物溶液pH=11,则F为Na元素; 0.001mol/L A的最高价氧化物对应的水化物和0.001mol/L D的最高价氧化物对应的水化物溶液的pH=3,且原子半径D>A,则D为Cl元素,A为N元素;0.001mol/L B的高价氧化物对应的水化物溶液的3<pH<7,结合原子半径可知B为C元素。0.001mol/L E的最高价氧化物对应的水化物溶液的pH<3,则E为S元素;
A.N和Na的简单离子的电子层结构相同,N的原子序数较小,故N3-的半径大于Na+,故A项错误;
B.A、B、D、E、F 五种元素中只有F是金属元素,故B项错误;
C.D的最高价氧化物水化物的化学式为HClO4,故C项错误;
D.D、E的气态氢化物分别为H2S和HCl,的稳定性HCl>H2S ,故D项正确;
综上,本题选D。


科目:高中化学 来源: 题型:
【题目】若R元素原子的质量数为A,Rm-的核外电子数为x,则w g Rm-所含中子的物质的量为( )
A.(A-x+m) molB.(A-x-m) mol
C.![]() (A-x+m) molD.
(A-x+m) molD.![]() (A-x-m) mol
(A-x-m) mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。
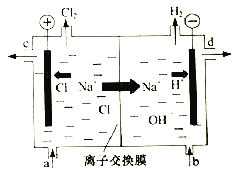
完成下列填空:
(1)写出电解饱和食盐水的离子方程式________________________________。
(2)阳极发生的是____________反应、阴极发生的是________反应(填“氧化”或“还原”)。
(3)精制饱和食盐水从图中________位置补充,氢氧化钠溶液从图中________位置流出。(选填“a”、“b”、“c”或“d”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某元素原子的价电子构型为4s24p1,该元素的符号为________。
(2)某元素+3价离子的3d轨道半充满,该元素的符号为________。
(3)A元素的负二价离子和B元素的正二价离子的电子层结构都与氩相同,A的离子结构示意图为________,B的元素名称为________。
(4)如图,第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的能量。如图是部分元素原子的第一电离能I1随原子序数变化的曲线(其中12~17号元素的有关数据缺失)。
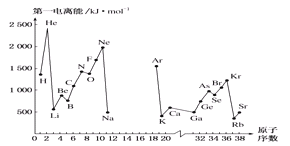
①认真分析图中同周期元素第一电离能的变化规律,推断Na~Ar元素中,Al的第一电离能的大小范围为________<Al<________;(填元素符号)。
②图中第一电离能最小的元素在周期表中的位置是第________周期________族。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe(OH)2由于在空气中易被氧化,制取时很难观察到白色沉淀现象,只能看到灰绿色,采用图装置使用Fe,H2SO4(稀),NaOH溶液可在还原性气氛中制取Fe(OH)2白色沉淀,且较长时间内不变色,其中C为弹簧夹。(提示:还原性气氛如氢气环境)

(1)则锥形瓶A中应加入的药品为________________________。
(2)锥形瓶B中应加入的药品为________________________。
(3)容器A中的反应开始后,请简单写出完成制备Fe(OH)2的后续操作步骤。
___________________________________________________________________。
(4)若在反应开始之前先关闭弹簧夹C,则实验现象为:______________________________;请写出此时B瓶中发生的化学反应的离子方程式:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔导电材料。下列说法一定正确的是( )

A. 该电池工作时,电子的流向外电路由A到B,内电路由B到A形成闭合回路
B. 电极B附近的HNO3浓度增大
C. A电极的反应为:NO2-e-+H2O==NO3-+2H+ NO-3e-+2H2O===NO3-+4H+
D. 该电池工作时,每消耗11.2LO2(标准状况下),可以除去含1molNO和NO2的混合尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,四种溶液的pH如下:
① | ② | ③ | ④ | |
pH | 3 | 3 | 11 | 11 |
溶液 | 盐酸 | 醋酸 | NaOH溶液 | 氨水 |
(1)③的溶液中由水电离出c(H+)水·c(OH-)水=______________(mol/L)2。
(2)②中加入少量醋酸钠晶体后,溶液的pH________。(填“增大”、“减小”或“不变”)
(3)②和③两溶液等体积混合,所得溶液中c(Na+)______c(CH3COO-)(填“>”、“<”或“=”)。
(4)若一定体积的①和④恰好完全反应生成氯化铵溶液,该溶液中离子浓度由大到小的顺序是_________________________________。
(5)25℃时,a mol/L醋酸溶液与b mol/LNaOH溶液等体积混合后pH=7,则醋酸的电离常数Ka=__________。(用含a、b的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是( )
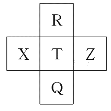
A.R与Q的电子数相差26
B.非金属性:Z>T>X
C.气态氢化物稳定性:R<T<Q
D.最高价氧化物对应的水化物的酸性:T<Q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某天然拒食素具有防御非洲大群蚯蚓的作用,其结构简式如图所示(未表示出原子或原子团的空间排列)。该拒食素与下列某试剂充分反应,所得有机物分子的官能团数目增加,则该试剂是

A. H2
B. Ag(NH3)2OH溶液
C. HBr
D. Br2的CCl4溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com