
【题目】若R元素原子的质量数为A,Rm-的核外电子数为x,则w g Rm-所含中子的物质的量为( )
A.(A-x+m) molB.(A-x-m) mol
C.![]() (A-x+m) molD.
(A-x+m) molD.![]() (A-x-m) mol
(A-x-m) mol
科目:高中化学 来源: 题型:
【题目】一种三室微生物燃料电池污水净化系统原理如下图所示,图中含酚废水中有机物可用C6H6O表示,左、中、右室间分别以离子交换膜分隔。下列说法不正确的是( )
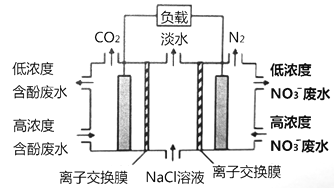
A. 左池的pH值降低
B. 右边为阴离子交换膜
C. 右池电极的反应式:2NO3-+10e-+12H+= N2↑+ 6H2O
D. 当消耗0.1molC6H6O,在标准状况下将产生0.28mol氮气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,属于盐类水解反应的是
A. Na2CO3溶液:CO32- + 2H2O ![]() H2CO3 + 2OH-
H2CO3 + 2OH-
B. NaHCO3溶液:HCO3- + H2O ![]() CO32- + H3O+
CO32- + H3O+
C. NaHS溶液:HS- + H2O ![]() H2S + OH-
H2S + OH-
D. KF溶液:F- + H2O = HF + OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚乙烯醇肉桂酸酯(M)可用作光刻工艺中的抗腐蚀涂层,其合成路线如下:
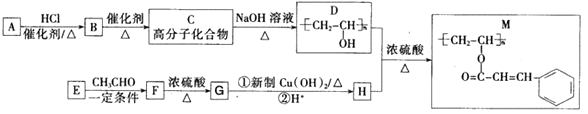
已知:

请回答:
(1)B的化学名称为_______________;M中含氧官能团的名称为_______________;F→G的反应类型为____________________。
(2)C→D的化学反应方程式为_________________________________________。
(3)E的结构简式为_______________;H的顺式结构简式为___________________。
(4)同时满足下列条件的F的同分异构体有_________种(不考虑立体异构):①属于芳香族化合物;②能发生水解反应和银镜反应。写出其中一种核磁共振氢谱有4种吸收峰,其峰面积之比为6:2:1:1的物质的结构简式_________。
(5)参照上述合成路线和相关信息,以乙烯和乙醛为原料(无机试剂任选)合成有机物![]() , 设计合成路线_____________。
, 设计合成路线_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+F2(g)===2HF(g) 的能量变化如图所示,下列有关叙述中正确的是

A.氟化氢气体分解生成氢气和氟气的反应是放热反应
B.1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270 kJ
C.在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量
D.断裂1 mol H—H键和1 mol F—F 键吸收的能量大于形成2 mol H—F键放出的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像分别表示有关反应的反应过程与能量变化的关系,据此判断下列说法正确的是( )
A. 白磷比红磷稳定
白磷比红磷稳定
B. 石墨转变为金刚石是吸热反应
石墨转变为金刚石是吸热反应
C. S(g)+O2(g)=SO2(g)ΔH1,S(s)+O2(g)=SO2(g) ΔH2,则ΔH1 >ΔH2
S(g)+O2(g)=SO2(g)ΔH1,S(s)+O2(g)=SO2(g) ΔH2,则ΔH1 >ΔH2
D. CO(g)+H2O(g)=CO2(g)+H2(g) ΔH>0
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,某水溶液M中存在的粒子有Na+、A2-、HA-、H+、OH-、H2O和H2A。根据题意回答下列问题:
(1)H2A为_____酸(填“强”或“弱”),往H2A溶液中加水会使 c(H+)/c(H2A)的值________(填“增大”、“减小”或“不变”)。
(2)若M是由一种溶质组成的溶液,则M的溶质可以是Na2A或________。
①Na2A的水溶液pH________(填“<”、“>”或“=”)7,
原因是:______________________________(用离子方程式表示)
②往Na2A溶液中加入_______________可抑制其水解(选填字母序号)。
a.氯化铵固体 b.KOH固体 c. 水 d.升高温度
③已知Ksp(CuA)=1.3×10-36,往20mL 1 mol·L-1Na2A溶液中加入10 mL 1 mol·L-1 CuCl2溶液,混合后溶液中的Cu2+浓度为________mol·L-1。(忽略A2-的水解)
(3)若溶液M由10 mL 1.00 mol·L-1 H2A溶液与10 mL 1.00 mol·L-1 NaOH溶液混合而成,下列关于溶液M的说法正确的是________(选填字母序号)。
a.c(A2-) + c(HA-) + c(H2A) = 1 mol·L-1
b.若溶液显酸性,则c(Na+)>c(HA-) >c(H+)>c(A2-) >c(OH-)
c.离子浓度关系:c(Na+) + c(H+) = c(OH-) + c(HA-) + c(A2-)
d.25 ℃时,加水稀释后,n(H+)与n(OH-)的乘积变大
(4)浓度均为0.1 mol · L-1的Na2A、NaHA混合溶液中: ![]() = ______ 。
= ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均为短周期元素,原子序数依次增大,请根据表中信息回答下列问题:
元素 | 元素性质或结构 |
A | 最外层电子数是其内层电子数的2倍 |
B | B元素的单质在空气中含量最多 |
C | C元素在地壳中含量最多 |
D | D是同周期中原子半径最小的元素 |
E | E元素在同周期中金属性最强 |
F | F元素的最外层电子数等于周期序数 |
G | G元素原子M层上电子数比L上少2个电子。 |
(1)G在元素周期表中的位置________。
(2)B最简单气态氢化物的结构式____,属于____化合物(填“离子”或“共价”);E的最高价氧化物的水化物电子式____,所含化学键类型________。
(3)C、D、E、F、G简单离子半径由大到小顺序为:____(填离子符号)。
(4)用电子式表示G的氢化物的形成过程______。
(5)A元素的某氧化物与E元素的某含氧化合物反应生成单质的化学方程式是_______。
(6)E、F两元素最高价氧化物对应水化物相互反应的离子方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、D、E、F均为短周期元素(原子序数B<A<F<E<D)。25℃时,其最高价氧化物的水化物(设浓度均为0.001mol/L)溶液的pH和原子半径的关系如图所示。下列说法中正确的是
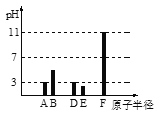
A. A和F的简单离子半径大小顺序:A < F
B. 上述五种元素中有两种元素是金属元素
C. D的最高价氧化物水化物的化学式为HDO3
D. D、E的气态氢化物的稳定性:D > E
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com