
【题目】常温下,某水溶液M中存在的粒子有Na+、A2-、HA-、H+、OH-、H2O和H2A。根据题意回答下列问题:
(1)H2A为_____酸(填“强”或“弱”),往H2A溶液中加水会使 c(H+)/c(H2A)的值________(填“增大”、“减小”或“不变”)。
(2)若M是由一种溶质组成的溶液,则M的溶质可以是Na2A或________。
①Na2A的水溶液pH________(填“<”、“>”或“=”)7,
原因是:______________________________(用离子方程式表示)
②往Na2A溶液中加入_______________可抑制其水解(选填字母序号)。
a.氯化铵固体 b.KOH固体 c. 水 d.升高温度
③已知Ksp(CuA)=1.3×10-36,往20mL 1 mol·L-1Na2A溶液中加入10 mL 1 mol·L-1 CuCl2溶液,混合后溶液中的Cu2+浓度为________mol·L-1。(忽略A2-的水解)
(3)若溶液M由10 mL 1.00 mol·L-1 H2A溶液与10 mL 1.00 mol·L-1 NaOH溶液混合而成,下列关于溶液M的说法正确的是________(选填字母序号)。
a.c(A2-) + c(HA-) + c(H2A) = 1 mol·L-1
b.若溶液显酸性,则c(Na+)>c(HA-) >c(H+)>c(A2-) >c(OH-)
c.离子浓度关系:c(Na+) + c(H+) = c(OH-) + c(HA-) + c(A2-)
d.25 ℃时,加水稀释后,n(H+)与n(OH-)的乘积变大
(4)浓度均为0.1 mol · L-1的Na2A、NaHA混合溶液中: ![]() = ______ 。
= ______ 。
【答案】弱 增大 NaHA > A2-+H2OHA-+OH-、HA-+H2OH2A+OH- b 3.9×10-36 bd 3/2
【解析】
(1)通过存在溶质分子来判断为弱酸,加水有利平衡向电离方向移动,但两者的浓度都变小,应从物质的量之比或Ka来解答;
(2)对水解产生的离子,可以看出可以是正盐或酸式盐,而水解平衡的移动影响因素中注意氯化铵水解的促进,然后在离子浓度的计算上,先判断量的关系,注意混合后要重新进行计算;
(3)溶液中溶质在混合后只有NaHA,电离程度与水解程度的对比,A为物料守恒,B为电离大于水解,C项为电荷守恒,D考查水的离子积常数,可以转化为浓度进行判断,可以看出体积增大,物质的量乘积也要跟着增高;
(4)根据物料守恒分析解答。
(1) 溶液中存在H2A,则说明H2A为弱电解质,往H2A溶液中加水促进电离,从电离平衡角度考虑,n(H+)增大,n(H2A)减小,所以,c(H+)/c(H2A)的值增大;
故答案为:弱,增大;
(2)根据题意可知,水溶液M中存在的粒子有Na+、A2-、HA-、H+、OH-、H2O和H2A,即可能是Na2A中A2-发生两步水解,一步水解生成HA-和OH-,二步水解HA-水解生成H2A和OH-,M也可能是NaHA,NaHA=Na++HA-,HA- H++A2-,HA-+H2OH2A+OH-,所以M可能是Na2A或NaHA;
①由上可知,H2A是弱酸,Na2A即为强碱弱酸盐,所以A2-离子水解使溶液显碱性,离子方程式为:A2-+H2OHA-+OH-,HA-+H2OH2A+OH-,所以Na2A的水溶液pH>7;
故答案为:NaHA ,>;A2-+H2OHA-+OH-,HA-+H2OH2A+OH-;
②a.氯化铵溶液中,NH4+水解生成H+,与A2-水解生成的OH-反应,促进A2-水解,故a错误;
b. 往Na2A溶液中加入KOH固体,使溶液中c(OH-)增大,抑制A2-水解,故b正确;
c. 往Na2A溶液中加入水促进水解,故c错误;
d.水解过程吸热,升高温度,使平衡向吸热反应方向移动,即促进水解,故d错误;
故答案为:b;
③20mL1mol/LNa2A溶液中n(A2-)=0.02mol,10mL1mol/LCuCl2溶液中n(Cu2+)=0.01mol,两者混合充分反应后n(A2-)剩余=0.01mol,即混合后c(A2-)剩余=0.01mol÷(0.02L+0.01L)=![]() mol/L,Ksp(CuA)=c(A2-) c(Cu2+)= 1.3×10-36,则c(Cu2+)=
mol/L,Ksp(CuA)=c(A2-) c(Cu2+)= 1.3×10-36,则c(Cu2+)=![]() =3.9×10-36(mol/L),
=3.9×10-36(mol/L),
故答案为:3.9×10-36;
(3) 溶液在混合后溶质只有NaHA,
a.根据物料守恒可得到:c(Na+)=c(A2-)+c(HA-)+c(H2A)=0.5 molL-1 ,故a错误;
b.由于溶液显酸性,则HA-的电离程度大于水解程度,可得到:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),故b正确;
c.根据电荷守恒可得到:c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-),故c错误;
d.水的离子积只和温度有关,加水稀释后水的离子积保持不变,Kw=c(H+)c(OH-)=[n(H+)n(OH-)]/V2,因为V增大,故n(H+)与n(OH-)的乘积变大,故d正确;
故答案为:bd;
(4) 浓度均为0.1 mol · L-1的Na2A、NaHA混合溶液中,根据物料守恒分别可得:c(Na+)= 2[c(A2-)+c(HA-)+c(H2A)]=0.2molL-1,c(Na+)= c(A2-)+c(HA-)+c(H2A)=0.1molL-1,则c(Na+)=0.2molL-1+0.1molL-1=0.3molL-1,c(A2-)+c(HA-)+c(H2A)=0.1molL-1+0.1molL-1=0.2molL-1,所以![]() =
=![]() =3/2,
=3/2,
故答案为:3/2。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列有关实验装置图的叙述中,正确的是

① ②
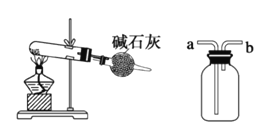
③ ④
A. 装置①:常用于分离互不相溶的液体混合物
B. 装置②:可用于吸收氯化氢、氨气等气体尾气,防止倒吸
C. 装置③:可用于实验室以氯化铵为原料制备少量NH3的实验
D. 装置④:先装满水,再从b口进NO气体,可收集NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】装置为锂钒氧化物二次电池,其成本较低,且对环境无污染:V2O5 + xLi![]() LixV2O5;在下图中用该电池电解含镍酸性废水可得到单质镍。下列说法正确的是
LixV2O5;在下图中用该电池电解含镍酸性废水可得到单质镍。下列说法正确的是
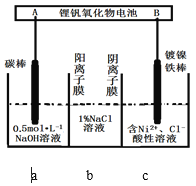
A.该电池充电时,B电极的电极反应式为LixV2O5-xe-=V2O5+xLi+
B.锂钒氧化物二次电池可以用LiCl水溶液作为电解液
C.电解过程中,b中NaCl溶液的物质的量浓度会增大
D.当锂钒氧化物二次电池中有7gLi参与放电时,一定能得到29.35g镍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若R元素原子的质量数为A,Rm-的核外电子数为x,则w g Rm-所含中子的物质的量为( )
A.(A-x+m) molB.(A-x-m) mol
C.![]() (A-x+m) molD.
(A-x+m) molD.![]() (A-x-m) mol
(A-x-m) mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3),是一种易燃气体。主要作为甲基化试剂和各类气雾推进剂,在制药、染料、农药工业中有许多独特的用途。其制备方法之一可由H2和CO合成:2CO(g) + 4H2(g) ![]() CH3OCH3(g) + H2O(g) ΔH<0
CH3OCH3(g) + H2O(g) ΔH<0
(1)该反应的ΔS_____0(填“>”、“<”或“=”)。
(2)在恒温恒容容器中,不能判断该反应达到化学平衡状态的依据是____(选填字母序号)。
a.二甲醚和水蒸气的体积比等于1︰1 b.容器中压强保持不变
c.υ正(H2)=4υ逆(CH3OCH3) d.容器中一氧化碳的物质的量不再改变
(3)在密闭容器中,反应达到平衡后下列措施能加快反应速率并提高CO转化率的是___(选填字母序号)。
a.将H2O(g)从体系中分离出来 b.缩小容器体积,使体系压强增大
c.加入合适的催化剂 d.升高体系温度
(4)T℃时,在2 L密闭容器中,充入4 molCO和8 molH2发生反应,测得H2的物质的量随时间变化如图中状态Ⅰ(图中实线)所示:

①T℃时,在状态Ⅰ的条件下,反应达到C点时体系处于平衡状态,以H2表示该反应的平均速率υ(H2)=_________, CO的转化率是________,反应的平衡常数KⅠ=_________。
②若仅改变某一条件,测得H2物质的量随时间变化如图状态Ⅱ所示,则KⅠ _____KⅡ(填“>”、“<”或“=”)。
③若仅改变某一条件时,测得H2的物质的量随时间变化如图状态Ⅲ所示,则改变的条件可能是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿付加德罗常数的值,下列说法正确的是( )
A.标准状况下,22.4 L H2与O2的混合气体所含原子数为2NA
B.1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C.15 g C2H6中含有共价键数目为7NA
D.1 mol Na2O2与足量CO2充分反应转移的电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见物质A~K之间存在如图所示的转化关系,其中A、D、E、H为单质,请回答下列问题。
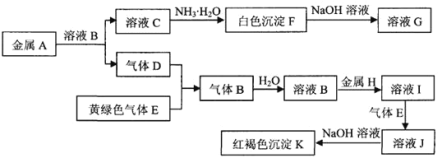
(1)下列物质的化学式是:C______,H______。
(2)反应“I→J”的离子方程式是____。
(3)检验J溶液中的金属离子的方法是(写出操作步骤、现象及结论)____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。
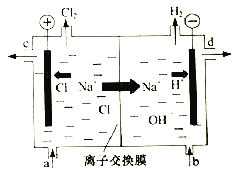
完成下列填空:
(1)写出电解饱和食盐水的离子方程式________________________________。
(2)阳极发生的是____________反应、阴极发生的是________反应(填“氧化”或“还原”)。
(3)精制饱和食盐水从图中________位置补充,氢氧化钠溶液从图中________位置流出。(选填“a”、“b”、“c”或“d”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,四种溶液的pH如下:
① | ② | ③ | ④ | |
pH | 3 | 3 | 11 | 11 |
溶液 | 盐酸 | 醋酸 | NaOH溶液 | 氨水 |
(1)③的溶液中由水电离出c(H+)水·c(OH-)水=______________(mol/L)2。
(2)②中加入少量醋酸钠晶体后,溶液的pH________。(填“增大”、“减小”或“不变”)
(3)②和③两溶液等体积混合,所得溶液中c(Na+)______c(CH3COO-)(填“>”、“<”或“=”)。
(4)若一定体积的①和④恰好完全反应生成氯化铵溶液,该溶液中离子浓度由大到小的顺序是_________________________________。
(5)25℃时,a mol/L醋酸溶液与b mol/LNaOH溶液等体积混合后pH=7,则醋酸的电离常数Ka=__________。(用含a、b的代数式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com