
【题目】设NA为阿付加德罗常数的值,下列说法正确的是( )
A.标准状况下,22.4 L H2与O2的混合气体所含原子数为2NA
B.1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C.15 g C2H6中含有共价键数目为7NA
D.1 mol Na2O2与足量CO2充分反应转移的电子数为2NA
【答案】A
【解析】
A.标准状况下,22.4LH2物质的量为![]() ,所含原子数为2NA,22.4LO2物质的量为
,所含原子数为2NA,22.4LO2物质的量为![]() ,所含原子数为2NA,因此22.4LH2与O2的混合气体,不管H2和O2的比例是多少,其所含原子数为2NA,A正确;
,所含原子数为2NA,因此22.4LH2与O2的混合气体,不管H2和O2的比例是多少,其所含原子数为2NA,A正确;
B.N2与H2反应是可逆反应,N2+3H2![]() 2NH3,因此1molN2与4molH2反应生成的NH3分子数小于2NA,B错误;
2NH3,因此1molN2与4molH2反应生成的NH3分子数小于2NA,B错误;
C.1个C2H6含有共价键7个,15gC2H6物质的量为![]() ,含有共价键数目为3.5NA,C错误;
,含有共价键数目为3.5NA,C错误;
D.2Na2O2+2CO2=2Na2CO3+O2,根据方程式1mol Na2O2转移2mol电子,因此1molNa2O2与足量CO2充分反应转移的电子数为2NA,D错误。
答案为A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】氢化亚铜(CuH)是-种难溶的物质,可用CuSO4溶液和“另一种物质”在40C~50C时反应来制备,CuH不稳定,它既能与HCl反应产生气体,又能在氯气中燃烧,以下有关判断不正确的是 ( )
A. CuH既可做氧化剂又可做还原剂
B. 另一种物质一定具有还原性
C. CuH跟HCl反应的化学方程式为:2CuH+2HCl=CuCl2+2H2↑+Cu
D. CuH在Cl2燃烧的化学方程式为:CuH+Cl2 ![]() CuCl+HCl
CuCl+HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚乙烯醇肉桂酸酯(M)可用作光刻工艺中的抗腐蚀涂层,其合成路线如下:
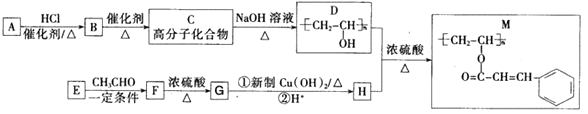
已知:

请回答:
(1)B的化学名称为_______________;M中含氧官能团的名称为_______________;F→G的反应类型为____________________。
(2)C→D的化学反应方程式为_________________________________________。
(3)E的结构简式为_______________;H的顺式结构简式为___________________。
(4)同时满足下列条件的F的同分异构体有_________种(不考虑立体异构):①属于芳香族化合物;②能发生水解反应和银镜反应。写出其中一种核磁共振氢谱有4种吸收峰,其峰面积之比为6:2:1:1的物质的结构简式_________。
(5)参照上述合成路线和相关信息,以乙烯和乙醛为原料(无机试剂任选)合成有机物![]() , 设计合成路线_____________。
, 设计合成路线_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像分别表示有关反应的反应过程与能量变化的关系,据此判断下列说法正确的是( )
A. 白磷比红磷稳定
白磷比红磷稳定
B. 石墨转变为金刚石是吸热反应
石墨转变为金刚石是吸热反应
C. S(g)+O2(g)=SO2(g)ΔH1,S(s)+O2(g)=SO2(g) ΔH2,则ΔH1 >ΔH2
S(g)+O2(g)=SO2(g)ΔH1,S(s)+O2(g)=SO2(g) ΔH2,则ΔH1 >ΔH2
D. CO(g)+H2O(g)=CO2(g)+H2(g) ΔH>0
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,某水溶液M中存在的粒子有Na+、A2-、HA-、H+、OH-、H2O和H2A。根据题意回答下列问题:
(1)H2A为_____酸(填“强”或“弱”),往H2A溶液中加水会使 c(H+)/c(H2A)的值________(填“增大”、“减小”或“不变”)。
(2)若M是由一种溶质组成的溶液,则M的溶质可以是Na2A或________。
①Na2A的水溶液pH________(填“<”、“>”或“=”)7,
原因是:______________________________(用离子方程式表示)
②往Na2A溶液中加入_______________可抑制其水解(选填字母序号)。
a.氯化铵固体 b.KOH固体 c. 水 d.升高温度
③已知Ksp(CuA)=1.3×10-36,往20mL 1 mol·L-1Na2A溶液中加入10 mL 1 mol·L-1 CuCl2溶液,混合后溶液中的Cu2+浓度为________mol·L-1。(忽略A2-的水解)
(3)若溶液M由10 mL 1.00 mol·L-1 H2A溶液与10 mL 1.00 mol·L-1 NaOH溶液混合而成,下列关于溶液M的说法正确的是________(选填字母序号)。
a.c(A2-) + c(HA-) + c(H2A) = 1 mol·L-1
b.若溶液显酸性,则c(Na+)>c(HA-) >c(H+)>c(A2-) >c(OH-)
c.离子浓度关系:c(Na+) + c(H+) = c(OH-) + c(HA-) + c(A2-)
d.25 ℃时,加水稀释后,n(H+)与n(OH-)的乘积变大
(4)浓度均为0.1 mol · L-1的Na2A、NaHA混合溶液中: ![]() = ______ 。
= ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表达式错误的是
A. 甲烷的电子式:![]()
B. 碳原子的L层电子轨道表示式:![]()
C. 硫离子的核外电子排布式:1s22s22p63s23p6
D. 碳-12原子:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均为短周期元素,原子序数依次增大,请根据表中信息回答下列问题:
元素 | 元素性质或结构 |
A | 最外层电子数是其内层电子数的2倍 |
B | B元素的单质在空气中含量最多 |
C | C元素在地壳中含量最多 |
D | D是同周期中原子半径最小的元素 |
E | E元素在同周期中金属性最强 |
F | F元素的最外层电子数等于周期序数 |
G | G元素原子M层上电子数比L上少2个电子。 |
(1)G在元素周期表中的位置________。
(2)B最简单气态氢化物的结构式____,属于____化合物(填“离子”或“共价”);E的最高价氧化物的水化物电子式____,所含化学键类型________。
(3)C、D、E、F、G简单离子半径由大到小顺序为:____(填离子符号)。
(4)用电子式表示G的氢化物的形成过程______。
(5)A元素的某氧化物与E元素的某含氧化合物反应生成单质的化学方程式是_______。
(6)E、F两元素最高价氧化物对应水化物相互反应的离子方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】柠檬酸(用H3R表示)是一种高效除垢剂,现用一定浓度的柠檬酸溶液去除水垢,溶液中H3R、H2R-、HR2-、R3-的含量随pH的变化如图所示。下列说法正确的是
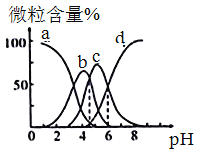
A. H3R的第二步电离常数Ka2(H3R)的数量级为10-4
B. Na2HR溶液中HR2-的水解程度大于电离程度
C. pH=6时,c(R3-)=c(HR2-)>c(H+)>c(OH-)
D. pH=4时,c(H+)=c(H2R-)+2c(HR2-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化锡可用作媒染剂。利用如图所示装置可以制备四氯化锡(部分夹持装置已略去);

有关信息如下表:
化学式 | SnCl2 | SnCl4 |
熔点/℃ | 246 | -33 |
沸点/℃ | 652 | 144 |
其他性质 | 无色晶体,易氧化 | 无色液体,易水解 |
回答下列问题:
(1)戊装置中冷凝管的进水口为___________(填“a”或“b”)。
(2)用甲装置制氯气,MnO4-被还原为Mn2+,该反应的离子方程式为________________________。
(3)将装置如图连接好,检查气密性,慢慢滴入浓盐酸,待观察到___________(填现象)后,开始加热丁装置,锡熔化后适当增大氯气流量,继续加热丁装置,此时继续加热丁装置的目的是:①促进氯气与锡反应;②_______________________________。
(4)如果缺少乙装置,可能产生的后果是___________________;己装置的作用是__________________。
(5)某同学认为丁装置中的反应可能产生SnCl2杂质,以下试剂中可用于检测是否产生SnCl2 的有_______________(填标号)。
a.FeCl3溶液(滴有KSCN) b.H2O2溶液 C.溴水 d.AgNO3溶液
(6)反应中用去锡粒1.19g,反应后在戊装置的试管中收集到2.38 gSnCl4,则SnCl4的产率为____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com