
ЁОЬтФПЁПЕчЛЏбЇдРэдкФмСПзЊЛЛЁЂН№ЪєвБСЖЕШЗНУцгІгУЙуЗКЁЃ
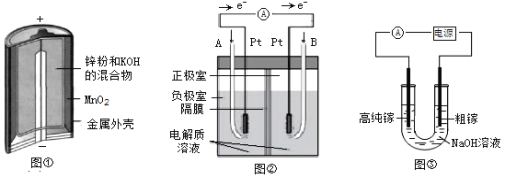
ЃЈ1ЃЉЭМЂйЪЧМюадаПУЬЕчГиЃЌдкИКМЋЗЂЩњЗДгІЕФЮяжЪЪЧ__________ЃЈЬюЁАZnЁБЛђЁАMnO2ЁБЃЉЃЌе§МЋЗЂЩњ_________ЗДгІЃЈЬюЁАбѕЛЏЁБЛђЁАЛЙдЁБЃЉЁЃ
ЃЈ2ЃЉЭМЂкЪЧМюадЕчНтжЪЕФЧтбѕШМСЯЕчГиЃЌBМЋЭЈШыЕФЦјЬхЮЊ________ЃЌAМЋЗЂЩњЕФЕчМЋЗДгІЪН____________________________________________ЁЃ
ЃЈ3ЃЉЕчНтЗЈПЩвдЬсДПДжяиЃЌОпЬхдРэШчЭМЂлЫљЪОЃК
ЂйДжяигыЕчдД___________МЋЯрСЌЃЈЬюЁАе§ЁБЛђЁАИКЁБЃЉЁЃ
ЂкяидкбєМЋШмНтЩњГЩЕФGa3+гыNaOHШмвКЗДгІЩњГЩGaO2ЃЃЌGaO2ЃдквѕМЋЗХЕчЕФЕчМЋЗДгІЪН______________________________________________________ЁЃ
ЃЈ4ЃЉгЩЯТСаЮяжЪвБСЖЯргІН№ЪєЃЌаыВЩгУЕчНтЗЈЕФЪЧ________(бЁЬюзжФИађКХ)ЁЃ
aЃЎNaCl bЃЎFe2O3ЁЁЁЁ cЃЎCu2SЁЁЁЁ dЃЎAl2O3
ЁОД№АИЁПZn ЛЙд O2 H2-2e-+2OH-=2H2O е§ GaO2-+3e-+2H2O=Ga+4OH- ad
ЁОНтЮіЁП
ИљОндЕчГиЁЂЕчНтГиЕФЙЙдьдРэвдМАЕчМЋЗДгІЗНГЬЪНЕФЪщаДЙцдђЗжЮіНтД№ЃЛИљОнГЃМћН№ЪєЕФвБСЖЗНЗЈЗжЮіНтД№ЁЃ
(1) ЭМЂйЪЧМюадаПУЬЕчГиЃЌЛюЦУН№ЪєаПзїИКМЋЃЌЗЂЩњбѕЛЏЗДгІЃЌMnO2зїе§МЋЃЌЗЂЩњЛЙдЗДгІЃЛ
ЙЪД№АИЮЊЃКZnЃЌЛЙдЃЛ
(2)ШМСЯЕчГижаЕчзгДгИКМЋСїЯђе§МЋЃЌдђAЕчМЋЗНЯђЪЧИКМЋЃЌBЕчМЋЗНЯђЪЧе§МЋЃЌШМСЯзіИКМЋЃЌМДAЕчМЋЭЈШыH2ЃЌBЕчМЋЭЈШыO2ЃЌAМЋЗЂЩњЕФЕчМЋЗДгІЮЊЃКH2-2e-+ 2OH-=2H2OЃЌBЕчМЋЗЂЩњЕФЕчМЋЗДгІЮЊЃКO2+4H2O+4e-=4OH-ЃЛ
ЙЪД№АИЮЊЃКO2ЃЌH2-2e-+ 2OH-=2H2OЃЛ
(3) ЂйЕчНтЗЈЬсДПДжяиЪБЃЌДжяизїбєМЋЃЌЪЇШЅЕчзгЃЌдђДжяигыЕчдДе§МЋЯрСЌЃЛ
ЙЪД№АИЮЊЃКе§МЋЃЛ
ЂкяидкбєМЋШмНтЩњГЩЕФGa3+гыNaOHШмвКЗДгІЩњГЩGaO2ЃЃЌИУЗДгІЕФРызгЗНГЬЪНЮЊЃКGa3+ЃЋ4OH-ЃНGaO2-+2H2OЃЌGaO2ЃдквѕМЋЗХЕчЪБЕУЕНЕчзгЩњГЩGaЕФЕчМЋЗДгІЃЛ
ЙЪД№АИЮЊЃКGaO2-+3e-+2H2O=Ga+4OH-ЃЛ
(4)ЕчНтЗЈвЛАугІгУгкЛюЦУН№ЪєЕФЕФвБСЖЃЌР§ШчЃКН№ЪєМиЁЂФЦЁЂУОЁЂТСЕФвБСЖЃЛ
ЙЪД№АИЮЊЃКadЁЃ


 УћЪІжИЕМЦкФЉГхДЬОэЯЕСаД№АИ
УћЪІжИЕМЦкФЉГхДЬОэЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЕЊбѕЛЏЮяОпгаВЛЭЌГЬЖШЕФЖОадЃЌРћгУЙЙГЩЕчГиЗНЗЈМШФмЪЕЯжгааЇЯћГ§ЕЊбѕЛЏЮяЕФХХЗХЃЌМѕЧсЛЗОГЮлШОЃЌгжФмГфЗжРћгУЛЏбЇФмЃЌЗЂЩњЗДгІ 6NO2+ 8NH3= 7N2+12H2OЃЌзАжУШчЭМЫљЪОЁЃЯТСаЙигкИУЕчГиЕФЫЕЗЈе§ШЗЕФЪЧ

A. ЮЊЪЙЕчГиГжајЗХЕчЃЌРызгНЛЛЛФЄашбЁгУвѕРызгНЛЛЛФЄ
B. ЕчзгДггвВрЕчМЋОЙ§ИКдиКѓСїЯђзѓВрЕчМЋ
C. ЕчМЋAМЋЗДгІЪНЮЊ2NH3 - 6e-=N2 +6H+
D. ЕБга4.48LNO2БЛДІРэЪБЃЌзЊвЦЕчзгЮяжЪЕФСПЮЊ 0.8mol
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПзуСПЭШмгквЛЖЈСПХЈЯѕЫсЃЌВњЩњNO2ЁЂN2O4ЁЂNOЕФЛьКЯЦјЬхЃЌетаЉЦјЬхШєгы1.12 L O2(БъзМзДПі)ЛьКЯКѓЭЈШыЫЎжаЃЌЦјЬхБЛЫЎЭъШЋЮќЪеЁЃШєЯђдЫљЕУШмвКжаМгШы5 molЁЄLЃ1 H2SO4ШмвК100 mLЃЌдђМЬајШмНтЕФCuЕФжЪСПЮЊ(ЁЁЁЁ)
A. 6.4 g B. 9.6 g C. 19.2 g D. 24 g
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГбЇЯАаЁзщЩшМЦЪЕбщЬНОПCuSO4ЗжНтВњЮя
ЂёЃЎМзЭЌбЇбЁдёЯТСазАжУЩшМЦЪЕбщЬНОПСђЫсЭЗжНтЕФЦјЬЌВњЮяSO3ЁЂSO2КЭO2ЃЌВЂбщжЄSO2ЕФЛЙдадЁЃ

ЛиД№ЯТСагаЙиЮЪЬт
(1)ЩЯЪізАжУАДЦјСїДгзѓжСгвХХађЮЊAЁЂDЁЂ___________EЁЂFЃЈЬюДњКХЃЉЁЃ
(2)зАжУDЕФзїгУЪЧ______________________ЃЛФмжЄУїгаSO3ЩњГЩЕФЪЕбщЯжЯѓЪЧ______________________ЁЃ
(3)дкЪЕбщЙ§ГЬжаCзАжУжаКьЩЋШмвКж№НЅБфЮЊЮоЩЋШмвКЃЌЫЕУїAжаЗжНтВњЮяга___________ЃЛД§CжагаУїЯдЯжЯѓКѓЃЌFПЊЪМЪеМЏЦјЬхЃЌFзАжУжаМЏЦјЦПЪеМЏЕНСЫЩйСПЦјЬхЃЌИУЦјЬхЪЧ___________ЃЈЬюЛЏбЇЪНЃЉЁЃ
(4)ЮЊСЫбщжЄSO2ЕФЛЙдадЃЌШЁEзАжУжаЗДгІКѓЕФШмвКгкЪдЙмжаЃЌЩшМЦШчЯТЪЕбщЃК
a.ЕЮМгЩйСПЕФNH4SCNШмвК b.ЕЮМгЩйСПЕФK3[Fe(CN)6]ШмвК
c.ЕЮМгЫсадKMnO4ШмвК d.ЕЮМгбЮЫсЫсЛЏЕФBaCl2ШмвК
ЦфжаЃЌЗНАИКЯРэЕФга___________ЃЈЬюДњКХЃЉЃЌаДГіEзАжУжаПЩФмЗЂЩњЗДгІЕФРызгЗНГЬЪНЃК________________ЁЃ
ЂђЃЎввЭЌбЇРћгУAжаВаСєЙЬЬхбщжЄЙЬЬхВњЮяЃЈМйЩшСђЫсЭвбЭъШЋЗжНтЃЉВщдФзЪСЯжЊЃЌЭга+2ЁЂ+1МлЃЌЧвЗжНтВњЮяжаВЛКЌ0МлЕФЭЁЃCu2OдкЫсадЬѕМўЯТВЛЮШЖЈЃЌЗЂЩњЗДгІЃКCu2O+2H+=Cu+Cu2++H2OЁЃ
(5)ЮЊСЫбщжЄЙЬЬхВњЮяжаЪЧЗёгаCu2OЃЌЩшМЦСЫЯТСа4жжЗНАИЃЌЦфжаФмДяЕНЪЕбщФПЕФЕФЪЧ___________ЁЃ
МзЃКШЁЩйСПВаСєЙЬЬхгкЪдЙмЃЌЕЮМгзуСПЕФЯЁЯѕЫсЃЌЙлВьШмвКбеЩЋЪЧЗёБфЮЊРЖЩЋ
ввЃКШЁЩйСПВаСєЙЬЬхгкЪдЙмЃЌЕЮМгзуСПЕФЯЁСђЫсЃЌЙлВьШмвКбеЩЋЪЧЗёБфЮЊРЖЩЋ
БћЃКШЁЩйСПВаСєЙЬЬхгкЪдЙмЃЌЕЮМгзуСПЕФЯЁбЮЫсЃЌЙлВьЪЧЗёгаКьЩЋЙЬЬхЩњГЩ
ЖЁЃКШЁЩйСПВаСєЙЬЬхгкЪдЙмЃЌЭЈШыЧтЦјЃЌМгШШЃЌЙлВьЪЧЗёЩњГЩКьЩЋЙЬЬх
(6)ОМьбщCuSO4ЗжНтЩњГЩCuOЁЂCu2OЁЂSO3ЁЂSO2КЭO2ЃЌЧвCuOЁЂCu2OЕФжЪСПжЎБШЮЊ5ЃК9ЃЌSO2ЁЂO2ЁЂSO3ЕФЬхЛ§жЎБШЃЈЭЌЮТЭЌбЙЯТВтЖЈЃЉЮЊ4ЃК3ЃК2ЁЃаДГіCuSO4ЗжНтЕФЛЏбЇЗНГЬЪНЃК______________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁППЩвдГфЗжЫЕУїЗДгІPЃЈgЃЉЃЋQЃЈgЃЉ![]() RЃЈgЃЉЃЋSЃЈgЃЉдкКуЮТЯТвбДяЕНЦНКтЕФЪЧ
RЃЈgЃЉЃЋSЃЈgЃЉдкКуЮТЯТвбДяЕНЦНКтЕФЪЧ
A. ЗДгІШнЦїФкЕФбЙЧПВЛЫцЪБМфИФБф
B. ЗДгІШнЦїФкPЁЂQЁЂRЁЂSЫФепЙВДц
C. PЕФЩњГЩЫйТЪКЭSЕФЩњГЩЫйТЪЯрЕШ
D. ЗДгІШнЦїФкЕФЦјЬхзмЮяжЪЕФСПВЛЫцЪБМфБфЛЏ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЖўМзУб(CH3OCH3)ЃЌЪЧвЛжжвзШМЦјЬхЁЃжївЊзїЮЊМзЛљЛЏЪдМСКЭИїРрЦјЮэЭЦНјМСЃЌдкжЦвЉЁЂШОСЯЁЂХЉвЉЙЄвЕжагааэЖрЖРЬиЕФгУЭОЁЃЦфжЦБИЗНЗЈжЎвЛПЩгЩH2КЭCOКЯГЩЃК2CO(g) + 4H2(g) ![]() CH3OCH3(g) + H2O(g) ІЄH<0
CH3OCH3(g) + H2O(g) ІЄH<0
ЃЈ1ЃЉИУЗДгІЕФІЄS_____0(ЬюЁАЃОЁБЁЂЁАЃМЁБЛђЁАЃНЁБ)ЁЃ
ЃЈ2ЃЉдкКуЮТКуШнШнЦїжаЃЌВЛФмХаЖЯИУЗДгІДяЕНЛЏбЇЦНКтзДЬЌЕФвРОнЪЧ____(бЁЬюзжФИађКХ)ЁЃ
a.ЖўМзУбКЭЫЎеєЦјЕФЬхЛ§БШЕШгк1ЉU1 bЃЎШнЦїжабЙЧПБЃГжВЛБф
cЃЎІде§ЃЈH2ЃЉЃН4ІдФцЃЈCH3OCH3ЃЉ dЃЎШнЦїжавЛбѕЛЏЬМЕФЮяжЪЕФСПВЛдйИФБф
ЃЈ3ЃЉдкУмБеШнЦїжаЃЌЗДгІДяЕНЦНКтКѓЯТСаДыЪЉФмМгПьЗДгІЫйТЪВЂЬсИпCOзЊЛЏТЪЕФЪЧ___(бЁЬюзжФИађКХ)ЁЃ
aЃЎНЋH2O(g)ДгЬхЯЕжаЗжРыГіРД bЃЎЫѕаЁШнЦїЬхЛ§ЃЌЪЙЬхЯЕбЙЧПдіДѓ
cЃЎМгШыКЯЪЪЕФДпЛЏМС dЃЎЩ§ИпЬхЯЕЮТЖШ
ЃЈ4ЃЉTЁцЪБЃЌдк2 LУмБеШнЦїжаЃЌГфШы4 molCOКЭ8 molH2ЗЂЩњЗДгІЃЌВтЕУH2ЕФЮяжЪЕФСПЫцЪБМфБфЛЏШчЭМжазДЬЌЂё(ЭМжаЪЕЯп)ЫљЪОЃК

ЂйTЁцЪБЃЌдкзДЬЌЂёЕФЬѕМўЯТЃЌЗДгІДяЕНCЕуЪБЬхЯЕДІгкЦНКтзДЬЌЃЌвдH2БэЪОИУЗДгІЕФЦНОљЫйТЪІд(H2)=_________ЃЌ COЕФзЊЛЏТЪЪЧ________ЃЌЗДгІЕФЦНКтГЃЪ§KЂё=_________ЁЃ
ЂкШєНіИФБфФГвЛЬѕМўЃЌВтЕУH2ЮяжЪЕФСПЫцЪБМфБфЛЏШчЭМзДЬЌЂђЫљЪОЃЌдђKЂё _____KЂђ(ЬюЁАЃОЁБЁЂЁАЃМЁБЛђЁАЃНЁБ)ЁЃ
ЂлШєНіИФБфФГвЛЬѕМўЪБЃЌВтЕУH2ЕФЮяжЪЕФСПЫцЪБМфБфЛЏШчЭМзДЬЌЂѓЫљЪОЃЌдђИФБфЕФЬѕМўПЩФмЪЧ_____________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊH2(g) + I2(g) ![]() 2HI(g) ЁїH < 0ЃЌгаЯрЭЌШнЛ§ЕФУмЗтШнЦїМзКЭввЃЌМзжаМгШыH2КЭI2Иї0.1mol ЃЌввжаМгШы0.1mol H2КЭ0.2mol I2ЃЌЯрЭЌЮТЖШЯТЗжБ№ДяЕНЦНКтЁЃЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ(ЁЁ )
2HI(g) ЁїH < 0ЃЌгаЯрЭЌШнЛ§ЕФУмЗтШнЦїМзКЭввЃЌМзжаМгШыH2КЭI2Иї0.1mol ЃЌввжаМгШы0.1mol H2КЭ0.2mol I2ЃЌЯрЭЌЮТЖШЯТЗжБ№ДяЕНЦНКтЁЃЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ(ЁЁ )
A. ввжаЗДгІЫйТЪБШМзжаЗДгІЫйТЪПь
B. ЦНКтЪБМзЁЂввСНШнЦїжаЛьКЯЮяЕФзмЮяжЪЕФСПжЎБШЮЊ2:3
C. ШєЦНКтЪБМзжаH2ЕФзЊЛЏТЪЮЊ40%ЃЌдђввжаH2ЕФзЊЛЏТЪДѓгк40%
D. ЦНКтКѓЃЌЯђввжадйМгШы0.1mol H2ЃЌНЈСЂаТЕФЦНКтЪБЃЌМзКЭввжаH2ЕФАйЗжКЌСПВЛЯрЭЌ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдкt ЁцЪБЃЌAgBrдкЫЎжаЕФГСЕэШмНтЦНКтЧњЯпШчЭМЫљЪОЁЃвбжЊt ЁцЪБAgClЕФKspЃН4ЁС10Ѓ10ЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧ(ЁЁЁЁ)
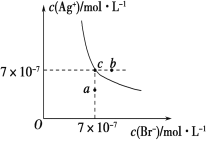
A. МгШыNaBrЙЬЬхЃЌAgBrЕФШмНтЖШМѕаЁЃЌKspвВМѕаЁ
B. дкAgBrБЅКЭШмвКжаМгШыЙЬЬхNaBrЃЌПЩЪЙШмвКжаcЕуБфЕНbЕу
C. ЭМжаaЕуЖдгІЕФЪЧгаAgBrГСЕэЩњГЩ
D. дкt ЁцЪБЃЌAgCl(s)ЃЋBrЃ(aq) AgBr(s)ЃЋClЃ(aq)ЕФЦНКтГЃЪ§KЁж816
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЬњДЅУНЪЧживЊЕФДпЛЏМСЃЌCOвзгыЬњДЅУНзїгУЕМжТЦфЪЇШЅДпЛЏЛюадЃКFe+5CO=Fe(CO)5ЃЛГ§ШЅCOЕФЛЏбЇЗДгІЗНГЬЪНЮЊЃК[Cu(NH3)2]OOCCH3+CO+NH3=[Cu(NH3)3(CO)]OOCCH3ЁЃ
ЧыЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉCЁЂNЁЂOЕФЕчИКадгЩДѓЕНаЁЕФЫГађЮЊ_________________ЃЌЛљЬЌFeдзгЕФМлЕчзгХХВМЭМЮЊ________________ЁЃ
ЃЈ2ЃЉFe(CO)5гжУћєЪЛљЬњЃЌГЃЮТЯТЮЊЛЦЩЋгЭзДвКЬхЃЌдђFe(CO)5ЕФОЇЬхРраЭЪЧ__________ЃЌгыCOЛЅЮЊЕШЕчзгЬхЕФЗжзгЕФЕчзгЪНЮЊ_________________ЁЃ
ЃЈ3ЃЉХфКЯЮя[Cu(NH3)2]OOCCH3жаЬМдзгЕФдгЛЏРраЭЪЧ_____________ЃЌХфЬхжаЬсЙЉЙТЖдЕчзгЕФдзгЪЧ___________________________________ЁЃ
ЃЈ4ЃЉгУ[Cu(NH3)2]OOCCH3Г§ШЅCOЕФЗДгІжаЃЌПЯЖЈга_______________аЮГЩЁЃ
aЃЎРызгМќ bЃЎХфЮЛМќ cЃЎЗЧМЋадМќ dЃЎЇвМќ
ЃЈ5ЃЉNaAlH4ОЇЬхЕФОЇАћШчЭМ ЃЌгыNaЃЋНєСкЧвЕШОрЕФAlH4Ѓга___________ИіЃЛNaAlH4ОЇЬхЕФУмЖШЮЊ_________gЁЄcmЃ3ЃЈгУКЌaЕФДњЪ§ЪНБэЪОЃЉЁЃ
ЃЌгыNaЃЋНєСкЧвЕШОрЕФAlH4Ѓга___________ИіЃЛNaAlH4ОЇЬхЕФУмЖШЮЊ_________gЁЄcmЃ3ЃЈгУКЌaЕФДњЪ§ЪНБэЪОЃЉЁЃ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com