
【题目】氮氧化物具有不同程度的毒性,利用构成电池方法既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,发生反应 6NO2+ 8NH3= 7N2+12H2O,装置如图所示。下列关于该电池的说法正确的是

A. 为使电池持续放电,离子交换膜需选用阴离子交换膜
B. 电子从右侧电极经过负载后流向左侧电极
C. 电极A极反应式为2NH3 - 6e-=N2 +6H+
D. 当有4.48LNO2被处理时,转移电子物质的量为 0.8mol
【答案】A
【解析】
由反应6NO2+8NH3=7N2+12H2O可知,反应中NO2为氧化剂,NH3为还原剂,则电极A为负极,电极B为正极。
A.A电极为负极,发生反应:2NH3-6e-+6OH-═N2+6H2O,由于OH-不断消耗,阴离子浓度降低,所以溶液中的OH-不断由正极区进入负极区,即离子交换膜为阴离子交换膜,A正确;
B.A电极为负极,电子从负极A电极经负载流向正极B电极,即从左侧电极经负载流向右侧电极,B错误;
C.A电极为负极,发生反应:2NH3-6e-+6OH-═N2+6H2O,在碱性溶液中不可能大量存在H+,C错误;
D.由于未指明气体所处的条件,所以不能根据气体体积确定气体的物质的量,也就不能确定电子转移数目,D错误;
故合理选项是A。


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是
A. 放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2
B. 充电时阳极反应为:Fe(OH)3-3e-+5OH-=![]() +4H2O
+4H2O
C. 放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D. 放电时正极附近溶液的碱性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)泡沫灭火器的灭火原理是(用离子方程式表示)_____________________。
(2)①已知T℃时,Kw=1×10-12,在该温度时,将pH=9的NaOH溶液aL与pH=2的H2SO4溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=3,则a:b=____。
②某二元酸(用H2A表示)在水中的电离方程式是:H2A=H++HA-,HA- ![]() H++A2-,则NaHA溶液中,写出符合原子(物料)守恒的各粒子浓度关系的等式_____________
H++A2-,则NaHA溶液中,写出符合原子(物料)守恒的各粒子浓度关系的等式_____________
(3)pH=2的两种一元酸HA和HB,体积均为100 mL,稀释过程中pH与溶液体积的关系如图。
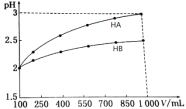
①则NaB水溶液是否呈中性?原因?______________(用离子方程式表示)。
②用NaOH溶液滴定HB溶液,指示剂宜选择_________,滴定终点现象为____________。
A.甲基橙 B.酚酞 C.石蕊
(4)NaHSO3溶液呈酸性,则溶液中,各离子浓度由大到小的顺序为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气可以制备大量的化工原料。请回答下列问题:
(1)由天然气制备合成气(CO和H2),进而可合成H2C2O4。
①欲加快H2C2O4溶液使5mL0.01mol/L酸性KMnO4溶液褪色,可采取的措施有__________、_______________(写两点)。
②下列可以证明H2C2O4是弱酸的是___________。
A.H2C2O4可以分解为CO、CO2和H2O
B.常温下,0.1mol/LNaHC2O4溶液中c(HC2O4-)+c(C2O42-)<0.lmol/L
C.0.1mol/LH2C2O4溶液25mL可以消耗0.1mol/LNaOH溶液50mL
D.常温下,0.05mol/L的H2C2O4溶液pH≈4
(2)已知:①CO(g)+H2(g)![]() C(s)+H2O(g) △H1=-130kJ/mol
C(s)+H2O(g) △H1=-130kJ/mol
②CH4(g)![]() C(s)+2H2(g) △H2=+76kJ/mol
C(s)+2H2(g) △H2=+76kJ/mol
③CO2(g)+H2(g)![]() CO(g)+H20(g) △H3=+41kJ/mol
CO(g)+H20(g) △H3=+41kJ/mol
则CH4(g)+CO2(g)![]() 2H2(g)+2CO(g) △H=________。
2H2(g)+2CO(g) △H=________。
(3)向2L容器中通入3molCO2、3molCH4,在不同温度下,以镍合金为催化剂,发生反应:CH4(g)+CO2(g)![]() 2H2(g)+2CO(g)。平衡体系中CH4和CO2的体积分数如下图。
2H2(g)+2CO(g)。平衡体系中CH4和CO2的体积分数如下图。
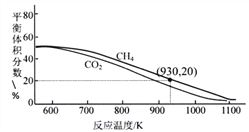
①高温下该反应能自发进行的原因是______________,930K时的平衡常数K=___________(保留两位小数)。
②请解释图中曲线随温度变化的原因______________。
③在700~1100K内,同温度下平衡转化率:CO2________CH4(填“大于”、“ 小于”或“等于”),结合(2)提供的反应分析,其原因可能是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀氨水中存在着下列平衡:NH3·H2O![]() NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是
NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是
①NH4Cl固体;②硫酸;③NaOH固体;④水;⑤加热;⑥加入少量MgSO4固体。
A. ①②③⑤ B. ③⑥ C. ③ D. ③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学原理,完成下列各题
(1)从化学键的角度分析,化学反应的过程就是旧键断裂和新键的形成过程。已知反应:N2(g)+ 3H2(g)![]() 2NH3(g) △H=﹣93kJ/mol。试根据表中所列键能数据,计算a 的数值为____kJ/mol。
2NH3(g) △H=﹣93kJ/mol。试根据表中所列键能数据,计算a 的数值为____kJ/mol。
化学键 | H﹣H | N﹣H | N≡N |
键能/(kJ/mol) | 436 | a | 945 |
(2)25 ℃时,将a mol/L氨水与0.01 mol/L盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显________(填“酸”“碱”或“中”)性。用含a的代数式表示NH3·H2O的电离常数Kb=________。
(3)向含有BaSO4的饱和溶液中
①加入Na2SO4溶液,则c(Ba2+)__________(填“变大”、“变小”或“不变”,下同)。
②若改加更多的固体BaSO4,则c(Ba2+)将__________。
(4)目前已开发出用电解法制取ClO2的新工艺。

①图中用石墨做电极,在一定条件下电解饱和食盐水制取ClO2。则阳极产生ClO2的电极反应式为___________。
②电解一段时间,当阴极产生的气体体积为112 mL (标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A. 碳酸钙跟醋酸反应:CaCO3+2H+=Ca2++H2O+CO2↑
B. 硫酸铝溶液中加过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH![]()
C. 向足量的溴化亚铁溶液中通入少量的氯气:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
D. 碳酸氢钠溶液与足量的氢氧化钡溶液混合:Ba2++2OH-+2HCO![]() =BaCO3↓+CO
=BaCO3↓+CO![]() +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)反应Fe+H2SO4=FeSO4+H2↑的能量变化趋势,如图所示:
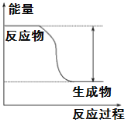
①该反应为________反应(填“吸热”或“放热”)。
②若要使该反应的反应速率加快,下列措施可行的是________(填字母)。
A.改稀硫酸为98%的浓硫酸 B.升高温度 C.改铁片为铁粉
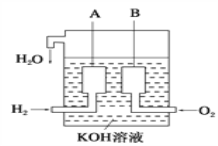
(2)美国阿波罗宇宙飞船上使用了一种新型燃料电池,其构造如图所示,A、B两个电极均由多孔的碳块组成,该电池的负极反应式为:_______________________________。
(3)一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。回答下列问题:
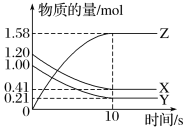
①从反应开始到10 s时,v(Z)=______________。
②反应的化学方程式为______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学原理在能量转换、金属冶炼等方面应用广泛。
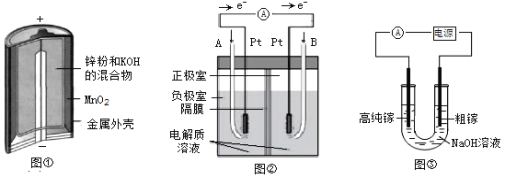
(1)图①是碱性锌锰电池,在负极发生反应的物质是__________(填“Zn”或“MnO2”),正极发生_________反应(填“氧化”或“还原”)。
(2)图②是碱性电解质的氢氧燃料电池,B极通入的气体为________,A极发生的电极反应式____________________________________________。
(3)电解法可以提纯粗镓,具体原理如图③所示:
①粗镓与电源___________极相连(填“正”或“负”)。
②镓在阳极溶解生成的Ga3+与NaOH溶液反应生成GaO2-,GaO2-在阴极放电的电极反应式______________________________________________________。
(4)由下列物质冶炼相应金属,须采用电解法的是________(选填字母序号)。
a.NaCl b.Fe2O3 c.Cu2S d.Al2O3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com