
【题目】某温度时,VIA元素单质与H2反应生成气态H2X的热化学方程式如下:
1/2O2(g) + H2(g) =H2O(g) ΔH = -242 kJ·mol-1
S(g) + H2(g) =H2S(g) ΔH = -20 kJ·mol-1
Se(g) + H2(g)![]() H2Se(g) ΔH = +81 kJ·mol-1
H2Se(g) ΔH = +81 kJ·mol-1
下列说法正确的是( )
A. 稳定性:H2O > H2S > H2Se
B. 降温有利于Se与H2反应生成H2Se
C. O2(g) + 2H2S(g)=2H2O(g) + 2S(g) ΔH = 444 kJ·mol-1
D. 随着核电荷数的增加,VIA族元素单质与H2的化合反应越容易发生
【答案】A
【解析】
A、相同物质的量的O2、S、Se三种物质,与氢气反应,生成物的能量越高,稳定性越差;
B、Se与H2反应为吸热反应,升高温度有利于反应进行;
C、根据已知方程式构建目标方程式,结合盖斯定律进行解答;
D、生成物的氢化物越稳定,其元素单质与H2的化合反应越容易。
A项、由热化学方程式可知,相同物质的量的O2、S、Se三种物质,与氢气反应,O2释放的能量最多,Se需吸收能量,能量越高,稳定性越差,所以稳定性:H2O>H2S>H2Se,故A正确;
B项、Se与H2反应生成H2Se的反应为吸热反应,升高温度平衡右移,有利于Se与H2反应生成H2Se,故B错误;
C项、将已知热化学方程式依次编号为①②③,由盖斯定律可知①×2-②得O2(g)+2H2S(g)═2H2O(g)+2S(g)△H=-444 kJmol-1,故C错误;
D项、H2X的稳定性:H2O>H2S>H2Se,生成物的氢化物越稳定,其元素单质与H2的化合反应越容易,所以随着核电荷数的增加,VIA族元素单质与H2的化合反应越难发生,故D错误。
故选A。


科目:高中化学 来源: 题型:
【题目】回答下列有关问题
(1)KW的数学表达式是KW =__________,温度升高KW的变化情况是______(选填“变大”“变小”或“不变”)。
(2)K通常表示化学平衡常数,K值越大表示该反应进行程度越________,对于反应2NO2(g) ![]() N2O4(g),其化学平衡常数K的数学表达式为K=[N2O4]/[NO2]2,式中[NO2]2表示的意义是_______________。
N2O4(g),其化学平衡常数K的数学表达式为K=[N2O4]/[NO2]2,式中[NO2]2表示的意义是_______________。
(3)Kα通常表示弱酸的电离平衡常数,Kα值越大表示该弱酸的酸性_______,对于某一元弱酸,当用蒸馏水稀释该酸时,溶液越稀,Kα的变化情况是________(选填“变大”“变小”或“不变”)
(4)Ksp表示难溶物的溶度积常数,该常数越大表示难溶物在水中的__________。
(5)实验室可用NaOH溶液吸收NO2 ,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O.含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol/L的CH3COONa溶液,则两溶液中c(NO3-)、c(NO2-) 和c(CH3COO-) 由大到小的顺序为_____________。(已知HNO2的电离常数Ka=7.1×104 mol/L,CH3COOH的电离常数为:Ka=1.7×105 mol/L),可使溶液A和溶液B的pH相等的方法是_____________。
A.向溶液A中加适量水 B.向溶液A中加适量NaOH
C.向溶液B中加适量水 D.向溶液B中加适量NaOH.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求回答下列问题:
(1)醇的官能团的名称是_____。
(2)某气态有机物相对于氢气的密度为14,则其结构简式为_____。
(3)某有机物的结构简式如图所示,则其一氯代物共有_____种。

(4)新戊烷用系统命名法命名应为_____。
(5)分别将等物质的量的C3H8、C4H8完全燃烧,消耗氧气质量多的是_____(填分子式)。
(6)下列最简式中,只能代表一种有机物的有_____(选填对应的序号)。
①CH3 ②CH2 ③CH2O ④CH4O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA 为阿伏加德罗常数的值,下列说法不正确的是( )
A.0.l mol Cl2与足量的铁粉充分反应转移的电子数为 0.2 NA
B.1.0 mol CH4 与Cl2 在光照下反应生成的 CH3Cl 分子数为 1.0 NA
C.标准状况下,11.2 L甲烷和乙烯(C2H4)混合物中含氢原子数目为2 NA
D.0.1mol Cl2 通入水中,HClO、Cl-、ClO-粒子数之和小于 0.2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置或操作进行相应实验,能达到实验目的的是
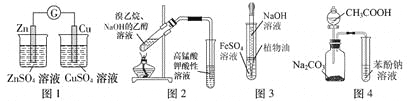
A. 用图1装置验证化学能转化为电能
B. 用图2装置检验溴乙烷与NaOH醇溶液共热产生的乙烯
C. 用图3装置制备氢氧化亚铁
D. 用图4装置证明酸性:CH3COOH>H2CO3>苯酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知短周期元素的离子:aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
A. 原子半径:A>B>D>CB. 原子序数:d>c>b>a
C. 离子半径:C>D>B>AD. 单质的还原性:A>B>D>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合韧是目前所采用的主要储氢材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。在基态Ti2+中,电子占据的最高能层符号为_______,该能层具有的原子轨道数为_____;
(2)液氨是富氢物质,是氢能的理想载体,利用![]() 实现储氢和输氢。下列说法正确的是________;
实现储氢和输氢。下列说法正确的是________;
a.NH3分子中氮原子的轨道杂化方式为sp2杂化
b.NH4+与PH4+、CH4、BH4-、ClO4-互为等电子体
c.相同压强时,NH3的沸点比PH3的沸点高
d.[Cu(NH3)4]2+离子中,N原子是配位原子
(3)已知NF3与NH3的空间构型相同,但NF3不易与Cu2+形成配离子,其原因是________;
II.氯化钠是生活中的常用调味品,也是结构化学中研究离子晶体时常用的代表物,其晶胞结构如图所示。
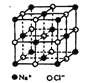
(1)设氯化钠晶体中Na+与跟它最近邻的Cl-之间的距离为r,则该Na+与跟它次近邻的C1-个数为______,该Na+与跟它次近邻的Cl—之间的距离为_____;
(2)已知在氯化钠晶体中Na+的半径为以a pm,Cl-的半径为b pm,它们在晶
体中是紧密接触的,则在氯化钠晶体中离子的空间利用率为_____;(用含a、b的式子袁示)
(3)纳米材料的表面原子占总原子数的比例很大,这是它有许多特殊性质的原因。假设某氯化钠颗粒形状为立方体,边长为氯化钠晶胞的10倍,则该氯化钠颗粒中表面原子占总原子数的百分比为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】AlPO4的沉淀溶解平衡曲线如图所示(T2>T1)。下列说法错误的是( )

A. AlPO4在b点对应的溶解度大于c点
B. AlPO4沉淀溶解是放热的过程
C. 图中四个点的Ksp:a=c=d<b
D. T1温度下,在饱和溶液中加入AlCl3可使溶液由c点变到a点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃的结构简式为 CH2=CH-C≡C![]() ,下列有关其几何结构的说法正确的是( )
,下列有关其几何结构的说法正确的是( )
A. 所有碳原子不可能在同一平面上 B. 有4个碳原子在同一直线上
C. 有5个碳原子在同一直线上 D. 有6个碳原子在同一直线上
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com