
【题目】(NH4)2Cr2O7可用作有机合成催化剂、媒染剂、显影液等。某化学兴趣小组对(NH4 )2Cr2O7的部分性质及组成进行探究。已知:Cr2O72-(橙色)+ H2O 2CrO42-(黄色)+ 2H+。请回答下列问题:
(1)取少量(NH4)2Cr2O7浓溶液于试管中,滴加足量浓KOH溶液,振荡、微热,观察到的主要现象是______________。
(2)为探究(NH4)2Cr2O7 (摩尔质量为252 g/mol)加热的分解产物,按下图连接好仪器,加热装置略去,在A中加入5.040 g样品进行实验。
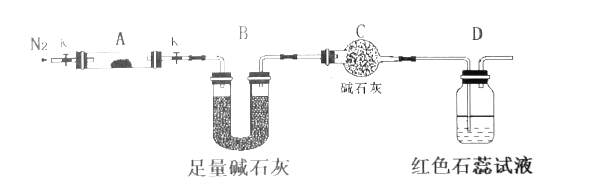
①仪器A的名称是______________。
②连接好装置,点燃酒精灯之前,先通入一段时间N2其目的为___________。
③反应结束后,依然要通一段时间的氮气的原因是________________________。
④加热A至恒重,观察到D中溶液不变色,同时测得A中残留物为Cr2O3、B中质量的变化为1.44 g,写出重铬酸铵加热分解反应的化学方程式:____________________。
(3)实验室常用甲醛法测定含(NH4)2Cr2O7的样品中氮的质量分数(杂质不发生反应),其反应原理为 2Ba2++Cr2O72- + H2O = 2BaCrO 4↓+2H+、4NH4++6HCHO =3H++6H2O+(CH2)6N4H+ [滴定时,1 mo1 (CH2)6N4H+ 与 1 mo1 H+ 相当],然后用 NaOH 标准溶液滴定反应生成的酸。
实验步骤:称取样品5.600 g,配成500 mL溶液,移取25.00 mL样品溶液于 250 mL锥形瓶中,用氯化钡溶液使Cr2O72-完全沉淀后,加入10 mL 20.00 mol·L-1的中性甲醛溶液,摇匀、静置5 min后,加入12滴酚酞试液,用0.200 mo1 L-1 NaOH 标准溶液滴定至终点。重复上述操作3次,最终滴定用去NaOH标准溶液体积的平均值为16.00 mL。
①若滴定终点时,俯视读数,则测定结果_____(填“偏大” “偏小”或“无影响”)。
②滴定计算得该样品中氮的质量分数为___________。
【答案】产生无色、有刺激性气味的气体;溶液由橙色变为黄色 硬质玻璃管 将装置内空气排尽 将A中分解产生的气体全部赶入B中,防止产生实验误差 (NH4)2Cr2O7 = Cr2O3+N2↑+4H2O 偏小 8.00%
【解析】
(1)根据加入碱对平衡Cr2O72-(橙色)+H2O2CrO42-(黄色)+2H+的影响,结合铵根离子的性质分析解答;
(2)①根据仪器A的结构分析判断;②根据装置内存在空气分析解答;③反应结束后,装置中仍残留少量生成的气体;④加热A至恒重,观察到D中溶液不变色,说明无氨气生成,生成的是氮气,同时测得A中残留物为Cr2O3、B中质量的变化为1.44g,为吸收的水蒸气,结合定量关系计算写出化学方程式;
(3)根据沉淀重铬酸根离子生成氢离子2xmol,铵根离子和甲醛反应生成氢离子相当于4molNH4+反应生成4molH+,利用氢离子物质的量和氢氧根物质的量相同计算解答。
(1)在试管中加入少量(NH4)2Cr2O7固体,溶液中存在滴加足量浓KOH溶液,振荡、微热,铵根离子与碱反应放出氨气、氢离子浓度减小,溶液中的Cr2O72-(橙色)+H2O 2CrO42-(黄色)+2H+平衡正向进行,溶液显黄色,因此观察到的主要现象是:固体溶解;产生无色、有刺激性气味的气体;溶液由橙色变为黄色,故答案为:固体溶解;产生无色、有刺激性气味的气体,溶液由橙色变为黄色;
(2)①根据装置图,仪器A为硬质玻璃管,故答案为:硬质玻璃管;
②连接好装置,点燃酒精灯之前,需进行的必要操作是:检查装置的气密性后通入一段时间氮气,将装置内空气排尽,故答案为:将装置内空气排尽;
③反应结束后,依然要通一段时间的氮气的原因是:将A中分解产生的气体全部赶入B中,防止产生实验误差,故答案为:将A中分解产生的气体全部赶入B中,防止产生实验误差;
④(NH4)2Cr2O7 (摩尔质量为252g/mol)的分解产物,在A中加入5.040g样品,物质的量=![]() =0.02mol,加热A至恒重,观察到D中溶液不变色,说明无氨气生成,生成的是氮气,同时测得A中残留物为Cr2O3、B中质量的变化为1.44g,为吸收的水蒸气物质的量=
=0.02mol,加热A至恒重,观察到D中溶液不变色,说明无氨气生成,生成的是氮气,同时测得A中残留物为Cr2O3、B中质量的变化为1.44g,为吸收的水蒸气物质的量=![]() =0.08mol,据此定量关系,反应的化学方程式为(NH4)2Cr2O7
=0.08mol,据此定量关系,反应的化学方程式为(NH4)2Cr2O7![]() Cr2O3+N2↑+4H2O,故答案为:(NH4)2Cr2O7
Cr2O3+N2↑+4H2O,故答案为:(NH4)2Cr2O7![]() Cr2O3+N2↑+4H2O;
Cr2O3+N2↑+4H2O;
(3)①若滴定终点时,俯视读数,读取消耗氢氧化钠溶液增小,则测定结果偏小,故答案为:偏小;
②反应原理为2Ba2++Cr2O72-+H2O=2BaCrO 4↓+2H+、4NH4++6HCHO=3H++6H2O+(CH2)6N4H+ [滴定时,1mo1(CH2)6N4H+与1mo1H+相当],然后用NaOH标准溶液滴定反应生成的酸,设25.00 mL样品溶液中含有(NH4)2Cr2O7的物质的量为x,则沉淀重铬酸根离子时生成氢离子2xmol,铵根和甲醛反应生成氢离子相当于4molNH4+反应生成4molH+,用0.200mo1L-1 NaOH标准溶液滴定至终点。重复上述操作3次,最终滴定用去NaOH标准溶液体积的平均值为16.00mL,2x+2x=0.016L×0.200mol/L,解得:x=0.0008mol,则原样品中含有(NH4)2Cr2O7的物质的量为0.0008mol×![]() =0.016mol,该样品中氮的质量分数=
=0.016mol,该样品中氮的质量分数=![]() ×100%=8.00%,故答案为:8.00%。
×100%=8.00%,故答案为:8.00%。


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:
【题目】下列实验与对应示意图的关系正确的是( )
A.向 NaAlO2 溶液中逐滴 滴加盐酸至过量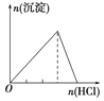
B.向 AlCl3 溶液中逐滴 滴加氨水至过量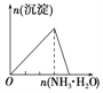
C.向明矾溶液中逐滴滴加Ba(OH)2 溶液至过量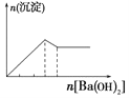
D.向澄清石灰水中缓缓 通入 CO2 至过量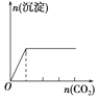
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用废弃旧电池的铜帽(主要成分为Zn和Cu)回收Cu并制备ZnO的部分实验过程如图所示:
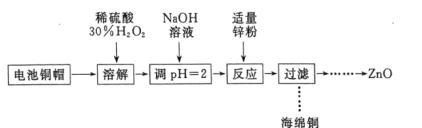
下列叙述错误的是( )
A. “溶解”操作中可用酸性条件下不断鼓入O2代替H2O2
B. 铜帽溶解后,将溶液加热至沸腾以除去溶液中过量的H2O2
C. 与加入锌粉反应的离子为Cu2+、H+
D. “过滤”操作后,将滤液蒸干、高温灼烧即可制取纯净的ZnO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求回答下列问题:
(1)醇的官能团的名称是_____。
(2)某气态有机物相对于氢气的密度为14,则其结构简式为_____。
(3)某有机物的结构简式如图所示,则其一氯代物共有_____种。

(4)新戊烷用系统命名法命名应为_____。
(5)分别将等物质的量的C3H8、C4H8完全燃烧,消耗氧气质量多的是_____(填分子式)。
(6)下列最简式中,只能代表一种有机物的有_____(选填对应的序号)。
①CH3 ②CH2 ③CH2O ④CH4O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学中几种常见物质的转化关系如下图所示:
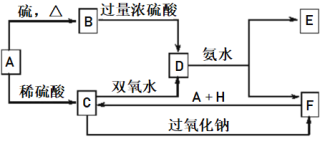
已知A是一种单质,将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:
(1)写出C的溶液与双氧水反应的离子方程式:_________________。
(2)写出鉴定E中阳离子的实验方法和现象:________________。
(3)F是一种难溶物质,其溶度积常数为1.0×10-39。向D溶液中加碱调节至pH为_______时,铁离子刚好沉淀完全(离子浓度小于1.0×10-5 mol·L-1时,即可认为该离子沉淀完全)。
(4)已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= –99 kJ·mol-1,单质硫的燃烧热为296 kJ·mol-1,计算由S(s)生成3 molSO3(g)的△H=__________kJ·mol-1。
(5)在200 mL 1.5 mol·L-1 NaOH溶液中通入标准状况下4.48L CO2气体,完全反应后所得溶液中,各种离子浓度由大到小的顺序是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA 为阿伏加德罗常数的值,下列说法不正确的是( )
A.0.l mol Cl2与足量的铁粉充分反应转移的电子数为 0.2 NA
B.1.0 mol CH4 与Cl2 在光照下反应生成的 CH3Cl 分子数为 1.0 NA
C.标准状况下,11.2 L甲烷和乙烯(C2H4)混合物中含氢原子数目为2 NA
D.0.1mol Cl2 通入水中,HClO、Cl-、ClO-粒子数之和小于 0.2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知短周期元素的离子:aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
A. 原子半径:A>B>D>CB. 原子序数:d>c>b>a
C. 离子半径:C>D>B>AD. 单质的还原性:A>B>D>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列有关图象,说法正确的是
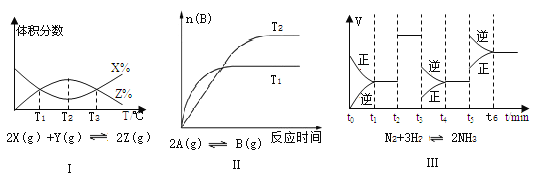
A. 由图Ⅰ知,该反应的△H>0 B. 由图Ⅱ知,该反应为放热反应
C. 由图Ⅲ知,t3时一定是采取降低反应温度的措施 D. 由图Ⅲ知,反应在t6时,NH3体积分数最大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com