
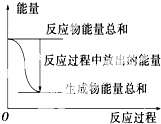
| A、反应过程中能量关系如上图表示,则该反应为放热反应 |
| B、若将其设计为原电池,当有32.5 g锌溶解时,正极放出气体一定为11.2 L |
| C、化学反应的焓变与反应方程式的计量数有关 |
| D、若将该反应设计成原电池,锌为负极 |


科目:高中化学 来源: 题型:
| A、0.1 mol?L-1氨水,溶液的pH<13 |
| B、0.1 mol?L-1氨水加水稀释,溶液中c(H+)和c(OH-)都减小 |
| C、0.1 mol?L-1醋酸溶液中:c(H+)=c(CH3COO-) |
| D、0.1 mol?L-1醋酸与0.1 mol?L-1NaOH溶液等体积混合所得溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b |
| B、在滴有酚酞溶液的氨水中,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7 |
| C、1.0×10-3 mol/L盐酸的pH=3.0,1.0×10-8mol/L盐酸的pH=8.0 |
| D、25℃时,若1 mL pH=1的盐酸与100 mL NaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH=11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、10 mL 1 mol/L FeCl3溶液 |
| B、50 mL 0.3 mol/L NaCl溶液 |
| C、10 mL 0.2 mol/L CaCl2溶液 |
| D、200 mL 0.1 mol/L NH4Cl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、铅蓄电池的A极为正极,电极材料为PbO2 |
| B、铅蓄电池工作过程中负极质量增加 |
| C、该电解池的阴极反应为:2NO3-+6H2O+10e-=N2↑+12OH- |
| D、若电解过程中转移2moL电子,则交换膜两侧电解液的质量变化差(△m左-△m右)为10.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CaCO3+2HCl=CaCl2+CO2↑+H2O | ||||
| B、CaO+H2O=Ca(OH)2 | ||||
C、CaCO3
| ||||
| D、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、18 g水中所含的电子数为10NA |
| B、1 mol氧中有2NA个氧原子 |
| C、0.3 mol?L-1Na2SO4溶液中含0.6NA个Na+ |
| D、11.2L氮气中含NA个氮原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、Ca2+、Cl-、HCO3- |
| B、Na+、Fe3+、Cl-、HCO3- |
| C、Fe2+、Fe3+、Cl-、NO3- |
| D、Fe2+、Mg2+、Cl-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com